Attività elettrochimica dell'elettrodo positivo Materiale della batteria agli ioni di sodio P2-Nax[Mg0,33Mn0,67]O2
Autore: ZHANG Xiaojun1, LI Jiale1,2, QIU Wujie2,3, YANG Miaosen1, LIU Jianjun2,3,4
1. Centro sci-tecnologico della provincia di Jilin per la conversione pulita e l'utilizzo di alto valore della biomassa, Northeast Electric Power University, Jilin 132012, Cina
2. Laboratorio statale chiave di ceramica ad alte prestazioni e microstruttura superfine, Istituto di ceramica di Shanghai, Accademia cinese delle scienze, Shanghai 200050, Cina
3. Centro di scienza dei materiali e ingegneria optoelettronica, Università dell'Accademia cinese delle scienze, Pechino 100049, Cina
4. Scuola di Chimica e Scienza dei Materiali, Hangzhou Institute for Advanced Study, Università dell'Accademia Cinese delle Scienze, Hangzhou 310024, Cina
Astratto
Con i vantaggi del basso costo e dell’ampia distribuzione delle materie prime, le batterie agli ioni di sodio sono considerate i migliori materiali alternativi per materiali catodici delle batterie agli ioni di litio. Nella fase P2 NaMnO2 con strati struttura, la soluzione solida binaria dello strato di metallo di transizione può essere efficace migliorare le prestazioni elettrochimiche del materiale dell'elettrodo. In questo studio, il modello strutturale di Nax[Mg0.33Mn0.67]O2 con ione Mg la soluzione solida è stata costruita utilizzando il modello Coulombiano. IL i calcoli basati sui principi primi hanno rivelato che la tensione di scarica di Nax[Mg0,33Mn0,67]O2 ha raggiunto 3,0 V a una contenuto di ioni sodio inferiore a 0,67. Densità elettronica di stati e carica l'analisi della popolazione ha mostrato che la soluzione solida di Mg ha motivato l'anionico attività elettrochimica dell'ossigeno reticolare nella fase P2 Nax[Mg0,33Mn0,67]O2, che ha trasformato il meccanismo di reazione elettrochimica del sistema da cationico e anionico reazione redox sinergica alla reazione redox anionica reversibile. Questo La trasformazione fornisce un nuovo metodo per la progettazione dei materiali degli elettrodi per le batterie agli ioni di Na, nonché un nuovo approccio per l'ottimizzazione e esplorazione di altre batterie ioniche.
Parole chiaveï¼ batteria agli ioni di sodio ; elettrochimico attività ; primo principio ; drogaggio di metalli alcalini
TOB NEW ENERGY fornisce un set completo di materiali per batterie, macchine per batterie, soluzione per linee di produzione di batterie e tecnologia per batterie a stato solido, Produzione di batterie agli ioni di sodio e batterie agli ioni di litio.
Berthelot et al.[10] lo hanno scoperto nell'ossido stratificato NaTMO2 contenente un singolo metallo di transizione (TM), il sodio ioni e posti vacanti sono ordinati nello strato di sodio puro, risultando in molti piattaforme di tensione per questo tipo di ossido durante il processo di scarica. . Questo comporta un rapido decadimento della capacità specifica ed una significativa riduzione della capacità prestazioni del ciclo, quindi è l'efficienza di conversione energetica di questo tipo di ossido Basso. Gli elementi solidi della soluzione vengono introdotti nello strato di metallo di transizione formano una disposizione mista di metalli di transizione binari o anche multi-elemento. IL il materiale dell'elettrodo contiene un gran numero di cariche disordinate, che possono sopprime efficacemente la piattaforma di tensione di cui sopra e migliora la conversione dell'energia efficienza. Yabuuchi et al.[11]hanno utilizzato Na2CO3, (MgCO3)4Mg(OH)2·5H2O e MnCO3 come materie prime. È stata condotta una reazione allo stato solido a 900°C per 12 ore per ottenere un elettrodo Na2/3[Mg1/3Mn2/3]O2 con fase P2 disordinata binaria materiale con soluzione solida di Mg. Lo hanno scoperto ad una densità di corrente di 10 mA/g, la capacità specifica iniziale della fase P2 preparata Il materiale catodico Na2/3[Mg1/3Mn2/3]O2 era di circa 150 mAh/g[11]. Leggermente inferiore alla capacità specifica di Na2/3MnO2 (184 mAh/g). Bruce et al.[12]hanno scoperto che sebbene ci fosse una reazione elettrochimica del reticolo ossigeno nella fase P2 Na2/3[Mg1/3Mn2/3]O2, non si è verificata alcuna precipitazione di ossigeno osservato. Ciò dimostra che l'introduzione di Mg migliora la reversibilità del ciclo e capacità specifica reversibile del materiale. Tuttavia, durante la carica e processo di scarica, il meccanismo di reazione elettrochimica microscopica di il reticolo dell'ossigeno in questo sistema non è ancora chiaro, così come il meccanismo con cui Anche la soluzione solida di Mg migliora la stabilità del sistema non è chiara.
Pertanto, questo lavoro richiede la fase P2 Nax[Mg0.33Mn0.67]O2 come oggetto di ricerca e adotta i principi primi metodo di calcolo della teoria del funzionale della densità (DFT). Uno studio sistematico su l'attività elettrochimica e la stabilità strutturale della scarica prestazioni del materiale catodico Nax[Mg0.33Mn0.67]O2 con soluzione solida di Mg sono stati condotti gli ioni. Per chiarire il meccanismo microscopico dell'elettrodo materiali nelle reazioni elettrochimiche alla microscala degli elettroni e atomi, fornirà un riferimento per la comprensione dell'elettrochimica processi e progettazione di nuovi materiali.
1 Metodo di calcolo
I calcoli in questo lavoro sono basati su il pacchetto software VASP per la base delle onde piane[13,14] di densità teoria funzionale. Viene utilizzato il metodo dell'onda piana additiva[15], e il funzionale di correlazione di scambio è l'approssimazione del gradiente generalizzato (GGA) sotto forma di Perdew-Burker-Ernzerhof[13,16]. L'Hubbard viene introdotto il parametro U per correggere gli elettroni d di Mn e l'U effettivo il valore è 3,9 eV[17,18]. L'energia di taglio dell'onda del piano inferiore è 600 eV. Quando il rilassamento degli ioni è completo, le forze su tutti gli atomi sono minori superiore a 0,1 eV·nm-1. Quando si ottimizza la struttura cristallina, un 3×3×1 (72 atomi) viene utilizzata la struttura della supercella, la costante reticolare è 0,874 nm × 0,874 nm × 1,056 nm, e la griglia di punti k della zona di Brillouin è 3×3×3[19]. IL Per calcolare lo spettro di vibrazione del reticolo è stato utilizzato il metodo del fonone congelato il pacchetto software Phonopy. Al fine di evitare l'influenza periodica condizioni al contorno, per calcolare le condizioni al contorno è stata utilizzata una struttura di supercella 3×3×1 costanti di forza e spettri fononici della fase P2 NaMnO2 e Na[Mg0,33Mn0,67]O2. Il modello di Coulomb della carica puntiforme viene utilizzato per calcolare rapidamente l'occupazione ionica della struttura desodica e la configurazione di occupazione del Na con la più bassa L'energia di Coulomb viene selezionata per calcoli più accurati dei principi primi[20]. La tensione di scarica del materiale dell'elettrodo può essere espressa come[20]:
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\ testo{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
Dove G è l'energia totale del sistema corrispondente, ed e- è la carica dell'elemento[21].
2 Risultati e discussione
2.1 Caratteristiche microstrutturali e stabilità strutturale
Il gruppo spaziale della fase P2 NaMnO2 la struttura è R$\bar{3}m (Fig. 1)[22,23]. La configurazione spaziale della soluzione solida di Mg la struttura Na0.67[Mg0.33Mn0.67]O2 è simile a quella NaMnO2. Gli ioni Mg sostituiscono 1/3 degli ioni Mn nello strato di metallo di transizione. IL il rapporto ionico teorico tra Mg e Mn è 1:2. Caratterizzazione sperimentale trovata che con questo rapporto gli ioni Mg nella struttura Nax[Mg0.33Mn0.67]O2 si formano solo disposizioni disordinate con Mn, mantenendo l'ordine dello strato di Na[24]. Quando il rapporto ionico Mg:Mn1:2, Mg, Na e Mn formeranno una struttura disordinata disposizione dei cationi. Come mostrato nella Figura 1(A), la modalità di impilamento del reticolo l'ossigeno è ABBA..., Mg e Mn occupano rispettivamente i siti ottaedrici tra gli strati di ossigeno AB e Na occupa i siti del prisma triangolare tra i strati di ossigeno AA e BB[ 25,26]. Come mostrato nella Figura 1(B), c'è una disposizione a nido d'ape di Mg e Mn nello strato di metallo di transizione[27], che è simile alla disposizione tra Li e Mn nei composti ricchi di litio[28]. L'ottaedro [MgO6] è organizzato con 6 ottaedri [MnO6] che condividono bordi[29,30]. Nello strato di metalli alcalini del Struttura Na0.67[Mg0.33Mn0.67]O2, ci sono due siti reticolari per gli ioni sodio. Uno è organizzato con gli strati superiore e inferiore di ottaedri [MgO6] o [MnO6] condivisione dei bordi. L'altro è disposto complanarmente con gli strati superiore ed inferiore Ottaedri [MgO6] o [MnO6].
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
Fig. 1 Diagramma schematico di P2-Na2/3[Mg1/3Mn2/3]O2
In strutture con diversi ioni sodio contenuto, gli ioni sodio sono influenzati dall'interazione di Coulomb tra Mn e Mg nello strato di metalli di transizione e ioni Na nello strato di metalli alcalini, mostrando due diverse modalità di occupazione. Pertanto, questo lavoro utilizza innanzitutto il Coulomb modello per schermare rapidamente la configurazione Na0.67[Mg0.33Mn0.67]O2 della fase P2 con la più bassa energia di Coulomb. Per verificarne la razionalità, noi calcolato e simulato i modelli XRD di queste configurazioni schermate e li ha confrontati con i risultati misurati[11]. I risultati vengono mostrati nella Figura 2. I valori calcolati (016) e (110) sono leggermente spostati verso destra rispetto alla caratterizzazione sperimentale, che è dovuta principalmente al esistenza di strutture amorfe e difettose in alcuni piani cristallini del materiali preparati sperimentalmente. La struttura del modello computazionale è una struttura cristallina perfetta, quindi c'è una certa deviazione tra l'XRD ampliamento e intensità di picco della simulazione computazionale e del risultati sperimentali. Inoltre in questi vi è una disposizione degli ioni Na due piani cristallini, e l'inserimento e il distacco degli ioni Na è un'altra possibile motivo dello spostamento delle corrispondenti posizioni di picco. Dopo considerando gli effetti di cui sopra, la forma del picco e l'intensità della simulazione Gli XRD sono coerenti con i risultati sperimentali e il modello costruito può farlo riprodurre le informazioni microstrutturali nell'esperimento, indicandolo la struttura teoricamente vagliata è relativamente accurata e affidabile[31,32].
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
Fig. 2 Confronton di XRD calcolati e sperimentali modelli di Na0,67[Mg0,33Mn0,67]O2
Per studiare l'effetto del Mg solido soluzione sulla stabilità strutturale, abbiamo utilizzato i principi primi combinati con il "metodo del fonone congelato" per calcolare gli spettri di vibrazione del reticolo P2-NaMnO2 e P2-Na[Mg0,33Mn0,67]O2. Come mostrato nella Figura 3, l'onda del possessore non ha alcuna frequenza immaginaria nell'intera zona di Brillouin, il che lo indica P2-Na[Mg0.33Mn0.67]O2 ha stabilità dinamica. Confrontando gli spettri fononici di dei due materiali, si è riscontrato che il doping con Mg non ha modificato in modo significativo la gamma di frequenze di vibrazione e ha avuto un impatto minimo sulla vibrazione del reticolo. IL La struttura drogata con Mg ha mostrato anche una buona stabilità dinamica. Inoltre, Bruce et al. preparato con successo la fase P2 Na[Mg0.33Mn0.67]O2 con una soluzione solida di Mg, che ha ulteriormente dimostrato che il materiale ha proprietà termodinamiche aggiuntive stabilità. Pertanto, non è difficile vedere che P2-Na[Mg0,33Mn0,67]O2 ha buona stabilità strutturale.
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
Fig. 3 Curve di dispersione dei fononi di (A) NaMnO2 e (B) Na0,67[Mg0,33Mn0,67]O2
2.2 Analisi delle proprietà elettrochimiche della fase P2 Nax[Mg1/3Mn2/3]O2
Al fine di studiare l'effetto del doping con Mg sulle proprietà elettrochimiche dei materiali, abbiamo calcolato la scarica tensione della struttura della soluzione solida di Mg P2-Nax[Mg0.33Mn0.67]O2 (Figura 4). IL l'intervallo di concentrazione degli ioni Na è determinato sperimentalmente, cioè 0,11 x x 0,66 [11]. La Figura 4 (A) mostra i cambiamenti strutturali durante il include principalmente il processo di scarica e la tensione corrispondente (Figura 4(B)). tre piattaforme: 3,4, 2,9 e 2,1 V. La capacità teorica prevista è 152 mAh/g, che è sostanzialmente coerente con i risultati sperimentali[11]. La curva della tensione di scarica calcolata dai primi principi è leggermente superiore al risultato effettivamente misurato. Il motivo principale è che il primo il calcolo dei principi ignora l'influenza della misurazione sperimentale condizioni, come l'elettrolita, la conduttività degli ioni di litio sperimentale temperatura di misurazione, ecc. La nostra ricerca precedente lo ha dimostrato[33]. sebbene la curva della tensione di scarica calcolata sia superiore a curva misurata sperimentalmente, la tendenza al cambiamento generale è coerente. Pertanto si può ritenere che durante l'intero processo di dimissione, il la tensione di Nax[Mg0.33Mn0.67]O2 è coerente con i risultati sperimentali[12,20]. Quando x<66%, Nax[Mg0,33Mn0,67]O2 ha un voltaggio elevato di circa 3,0 V e non vi è alcuna evidente piattaforma di voltaggio aggiuntiva, indicando che la sostituzione di Mg2+ con Mn3+ ha l'effetto di inibire il riarrangiamento degli ioni sodio e cambiamento di fase strutturale. Precedenti studi di carica e scarica su NaMnO2 e altri sistemi hanno scoperto che la disposizione ordinata dei metalli di transizione è solitamente accompagnata da più piattaforme di tensione.
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
Fig. 4 (A) Cambiamenti strutturali calcolati dal DFT e (B) curva della tensione di scarica di P2-Nax[Mg0,33Mn0,67]O2 durante la scarica
In circostanze ideali, la valenza gli stati di Mg e Mn in Na2/3[Mg0,33Mn0,67]O2 sono rispettivamente +2 e +4, e non può continuare ad essere ossidato a stati di valenza più elevati. Pertanto, non esiste attività elettrochimica cationica nel sistema e carica e scarica Il processo del materiale è una reazione elettrochimica anionica. In Na0,67MnO2, lo stato di valenza iniziale degli ioni Mn è +3,33. Durante il processo di ricarica, Mn gli ioni possono trasferire 0,67 elettroni verso l'esterno per raggiungere una valenza stabile di +4. A questa volta, tutto il Na+ è stato rilasciato e l'ossigeno reticolare non lo è mai stato ha partecipato alla reazione elettrochimica[34]. Pertanto, il il processo di carica e scarica di Na0,67MnO2 appare come un cationico reazione elettrochimica. Molti studi hanno dimostrato che quando il numero di gli elettroni persi dall'ossigeno reticolare sono inferiori a 0,33, l'elettrochimico anionico la reazione ha una buona reversibilità[11-12,28]. L'eccessiva ossidazione degli anioni dell'ossigeno (il numero di elettroni persi è maggiore di 0,33) provoca la configurazione elettronica dell'ossigeno deviare dalla stabile regola dell'otto-accoppiatori, con conseguente reazione di trasformazione irreversibile e la formazione di un Legame OO. Potrebbe anche portare all'evoluzione dell'ossigeno e alla carica irreversibile e scarica della struttura dell'elettrodo[27,35]. In Na0,67[Mg0,33Mn0,67]O2, se si considera lo stato limite di perdita di carica. Quello cioè quando gli ioni Na sono completamente distaccati per formare Na0[Mg0,33Mn0,67]O2 struttura, Mg e Mn mantengono sempre le valenze +2 e +4. L'anione O è ossidato a -1,67 valenza, perdendo 0,33 elettroni, che è inferiore al limite della reazione elettrochimica anionica irreversibile. Pertanto, nel complesso creazione di aumento di Na0,67[Mg0,33Mn0,67]O2, l'ossigeno reticolare non ha bisogno essere riorganizzato spazialmente e la reazione elettrochimica è reversibile. L’introduzione di Mg2+ non solo mantiene la capacità specifica reversibile, ma aumenta anche la densità energetica del materiale aumentando la tensione di scarica.
Per dimostrare l'elettrochimica attività dell'ossigeno nel materiale Nax[Mg0.33Mn0.67]O2 durante lo scarico processo, abbiamo calcolato la densità elettronica degli stati (Figura 5) per il strutture di scarico iniziali e finali del materiale. Si è scoperto che durante il processo di scarica, gli ioni Na sono stati gradualmente incorporati, in numero totale di elettroni nel sistema aumentarono e il livello di Fermi si spostò a un livello più alto livello di energia. Il numero di buchi nell'orbita dell'O2p diminuisce gradualmente, indicando che gli elettroni che entrano nel sistema vengono trasferiti al vuoto orbite di ossigeno reticolare e l'ossigeno reticolare viene ridotto. Durante il processo di scarica del materiale dell'elettrodo, a cui partecipa l'ossigeno reticolare la reazione elettrochimica degli anioni. In questo momento non c’è quasi alcun cambiamento negli elettroni orbitali Mn-d, e non c'è trasferimento di carica, cioè il lo stato di valenza di Mn non cambia durante il processo di scarica, dimostrandolo Il Mn non è elettrochimicamente attivo[12,36]. Tuttavia, durante il processo di scarica di P2-NaxMnO2, gli elettroni continuano a riempire il Mn ad alta energia e O orbitali vuoti, indicando che sia Mn che O sono elettrochimicamente attivi e sono una tipica reazione elettrochimica in cui cooperano anioni e cationi.
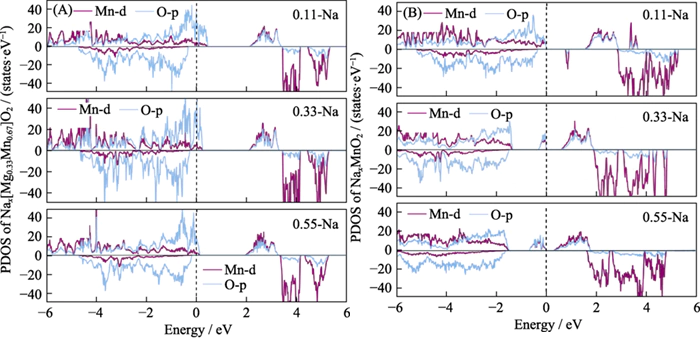
Fig. 5 Densità elettronica degli stati di (A) P2-Nax[Mg0,33Mn0,67]O2 e (B) P2-NaxMnO2 sotto diversi ioni Na contenuto durante lo scarico
PDOS: proiettato densità degli stati
Si può trarre una conclusione coerente attraverso l’analisi della popolazione di carica (Figura 6). Durante il processo di scarico di Nax[Mg0.33Mn0.67]O2, la quantità di carica degli ioni Mn sostanzialmente non cambia, quindi non partecipa alla reazione elettrochimica; nel processo di aumentando il contenuto di Na da 0,11 a 0,66, gli ioni O ottengono circa 0,2e- . Si è verificato un significativo riempimento di carica, mostrando attività elettrochimica anionica[37]. Attraverso l'analisi della popolazione carica di P2-NaxMnO2, è stato trovato che all'aumentare del contenuto di Na, Mn e O partecipano congiuntamente al reazione elettrochimica. Questo risultato è coerente con l’analisi di densità elettronica degli stati. È dimostrato che la soluzione solida di Mg cambia il meccanismo di reazione elettrochimica del sistema da anione e Reazione elettrochimica cooperativa cationica ad un anione reversibile reazione elettrochimica, e questo processo non influenza la carica e reversibilità di scarico del materiale.
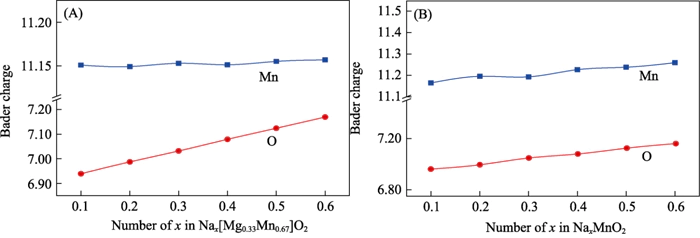
Fig. 6 Carica analisi di (A) Nax[Mg0,33Mn0,67]O2 e (B) P2-NaxMnO2 sotto diversi ioni sodio contenuto
3 Conclusione
Questo studio ha utilizzato i principi primi calcoli per studiare sistematicamente le caratteristiche microstrutturali, stabilità cinetica e attività elettrochimica della soluzione solida di Mg2+ P2 fase Nax[Mg1/3Mn2/3]O2. L'introduzione di Mg2+ cambia l'elettrochimico tipo di reazione del materiale dalla cooperativa anionica e cationica reazione elettrochimica di NaxMnO2 all'elettrochimico anionico reversibile reazione di Nax[Mg0,33Mn0,67]O2. Quando l'anione O in P2-Nax[Mg0.33Mn0.67]O2 partecipa alla reazione elettrochimica, l'intervallo di guadagno e perdita di carica è inferiore a 0,33, che ha una buona reversibilità. L'introduzione del Mg2+ non solo aumenta la tensione di scarica del materiale, ma mantiene anche la capacità specifica reversibile del materiale e, infine, aumenta il densità energetica del materiale.
Nei materiali degli elettrodi agli ioni di sodio, introducendo metalli alcalino terrosi nella transizione metal strato per cationico la soluzione solida è una nuova strategia di ottimizzazione delle prestazioni dei materiali. È basilare Il meccanismo è quello di innescare l'attività elettrochimica degli anioni mediante sacrificio l'attività elettrochimica dei cationi, modificando la reazione elettrochimica meccanismo del materiale, aumentando la tensione di scarica e, infine ottimizzando la densità energetica del materiale. Questa strategia non solo fornisce un nuovo metodo per la progettazione di materiali per elettrodi per batterie agli ioni di sodio, ma fornisce anche nuove idee per l'ottimizzazione e l'esplorazione di altri ioni batterie.
Riferimenti
[1] HU YING-YING, WEN ZHAO-YIN, RUI-KUN, et al. All'avanguardia stato della ricerca e sviluppo delle batterie al sodio. Stoccaggio dell'energia Scienza e tecnologia, 2013,2(2):81-90.
[2] SHEN GUAN-YE, LI CHEN, XU BING-LIANG, et al. Allocazione economica per il sistema di accumulo dell’energia considerando l’energia eolica. Giornale del Nordest Electric Power University, 2018,38(4):27-34.
[3] MA CHAO, ZHAO XIAO-LIN, KANG LI-TAO, et al. Non coniugato materiali anodici dicarbossilati per celle elettrochimiche. Angew. Chimica. interno Ed., 2018,57(29):8865-8870.
[4] RICCARDO W D, DACEK S T, KITCHAEV D A, et al. Fluorurazione di materiali catodici di ossido di metallo di transizione in eccesso di litio. Energia avanzata Materiali, 2018,8(5):1701533.
[5] XIANG XING-DE, ZHANG KAI, CHEN JUN. Progressi recenti e prospettive dei materiali catodici per batterie agli ioni di sodio. Avv. Mater., 2015,27(36):5343-5364.
[6] MA CHAO, ZHAO XIAO-LIN, HARRIS M M, et al. L'acido urico come composto elettrochimicamente attivo per batterie agli ioni di sodio: meccanismi di immagazzinamento graduale di Na+ della coniugazione Ï e anione di carbonio stabilizzato. Materiali applicati ACS e interfacce, 2017,9(39):33934-33940.
[7] LEE D H, XU JING, MENG Y S. Un catodo avanzato per batterie agli ioni di Na ad alta velocità ed eccellente stabilità strutturale. Fis. Chimica. Chimica. Fisica, 2013,15(9):3304-3312.
[8] KUBOTA K, YABUUCHI N, YOSHIDA H, et al. Ossidi stratificati come materiali per elettrodi positivi per batterie agli ioni di Na. Bollettino MRS, 2014,39(5):416-422.
[9] CLÃMENT R J, BRUCE P G, GREY C P. Recensioneâmanganese- ossidi di metalli di transizione di tipo P2 come materiali catodici per batterie agli ioni di sodio. Giornale del Società elettrochimica, 2015,162(14):A2589-A2604.
[10] BERTHELOT R, CARLIER D, DELMAS C. Elettrochimico studio del diagramma di fase P2-NaxCoO2. Naz. Mater., 2011,10(1):74-80.
[11] YABUUCHI N, HARA R, KUBOTA K, et al. Un nuovo elettrodo materiale per batterie ricaricabili al sodio: Na2/3[Mg0,28Mn0,72]O2 di tipo P2 con valori anomali capacità reversibile. J.Mater. Chimica. A, 2014,2(40):16851-16855.
[12] MAITRA U, CASA R A, SOMERVILLE J W, et al. Redox dell'ossigeno chimica senza eccesso di ioni di metalli alcalini in Na2/3[Mg0,28Mn0,72]O2. Naz. Chimica, 2018,10(3):288-295.
[13] GUO SHAO-HUA, SUN YANG, YI JIN, et al. Comprensione diffusione di ioni sodio in ossidi P2 e P3 stratificati tramite esperimenti e calcoli da principi primi: un ponte tra la struttura cristallina e prestazioni elettrochimiche. NPG Asia Materials, 2016,8:e266.
[14] JI HUI-WEI, KITCHAEV D A, LUN ZHANG-YAN, et al. Computazionale studio e realizzazione sperimentale di ioni di litio disordinati ad alta capacità catodi a base di Ni redox. Chimica di Materiali, 2019,31(7):2431-2442.
[15] LEE J, URBAN A, LI XIN, et al. Sbloccando il potenziale degli ossidi cationici disordinati per batterie al litio ricaricabili. Scienza, 2014,343(6170):519-522.
[16] URBAN A, LEE J, CEDER G. Il configurazionale spazio degli ossidi di tipo salgemma per elettrodi di batterie al litio ad alta capacità. Energia avanzata Materiali, 2014,4(13):1400478.
[17] CHAKRABORTY A, DIXIT M, AURBACH D, et al. Previsione accurata proprietà catodiche di materiali di ossido stratificato utilizzando la densità SCAN meta-GGA funzionale. npj computazionale Materiali, 2018,4:60.
[18] URBAN A, ABDELLAHI A, DACEK S, et al. Struttura elettronica Origine del disordine cationico negli ossidi dei metalli di transizione. Fis. Rev. Lett., 2017,119(17):176402.
[19] ASSAT G, TARASCON J M. Fondamentale comprensione e sfide pratiche dell'attività redox anionica negli ioni di litio batterie. Nature Energy, 2018,3(5):373-386.
[20] YABUUCHI N, NAKAYAMA M, TAKEUCHI M, et al. Origine di stabilizzazione e destabilizzazione nella reazione redox allo stato solido degli ioni ossido per batterie agli ioni di litio. Naz. Comunione, 2016,7:13814.
[21] SANNYAL A, AHN Y, JANG J. Principi primi studio sul siligene bidimensionale (2D SiGe) come materiale anodico di un batteria agli ioni di metalli alcalini. Computazionale Scienza dei materiali, 2019,165:121-128.
[22] LI HONG, HU YONG-SHENG, PAN HUI-LIN, et al. Progressi della ricerca avanti struttura del materiale dell'elettrodo della batteria di accumulo agli ioni di sodio a temperatura ambiente. Scienzia Sinica Chimica, 2014,44(8):1269-1279.
[23] WANG YUE-SHENG, XIAO RUI-JUAN, HU YONG-SHENG, et al. Elettrodo con cationi disordinati P2-Na0.6[Cr0.6Ti0.4]O2 per batterie ricaricabili simmetriche agli ioni di sodio ad alta velocità. Naz. Comunione, 2015,6:6954.
[24] WANG QIN-CHAO, MENG JING-KE, YUE XIN-YANG, et al. Sintonizzazione strutturata P2 materiale catodico mediante sostituzione del sito Na Mg per batterie agli ioni di Na. J. Am. Chimica. Soc., 2019,141(2):840-848.
[25] MENDIBOURD A, DELMAS C, HAGENMULLER C. Elettrochimico intercalazione e deintercalazione di bronzi NaxMnO2. Academic Press, 1985,57(3):323-331.
[26] SOMERVILLE J W, SOBKOWIAK A, TAPIA-RUIZ N, et al. Natura del Fase âZâ nei catodi di batterie stratificate agli ioni di Na. Energia e Scienze ambientali, 2019,12(7):2223-2232.
[27] QU JIE, WANG DONG, YANG ZU-GUANG, et al. Doping ionico Regolazione del catodo composito indotta dalla variazione del sito: un caso di studio di tunnel a strati Na0,6MnO2 con drogaggio Mg2+ nel sito Na/Mn. Richiesta ACS. Madre. Interfacce, 2019,11(30):26938-26945.
[28] SATO T, SATO K, ZHAO WEN-WEN, et al. Metastabile e Ossidi di tipo salgemma disordinati da cationi di dimensioni nanometriche: rivisitazione dello stechiometrico LiMnO2 e NaMnO2. Giornale dei materiali Chimica A, 2018,6(28):13943-13951.
[29] GUIGNARD M, DELMAS C. Utilizzando una batteria per sintetizzare nuovi ossidi di vanadio. Selezione chimica, 2017,2(20):5800-5804.
[30] WANG PENG-FEI, YAO HU-RONG, LIU XIN-YU, , et al. Il disordine Na+/vacancy promette batterie agli ioni di Na ad alta velocità. Science Advances, 2018, 4(3): eaar6018.
[31] KIM H, KIM D J, SEO D H, et al. Studio ab initio dell'intercalazione del sodio e delle fasi intermedie in Na0,44MnO2 per batterie agli ioni di sodio. Chimica di Materiali, 2012,24(6):1205-1211.
[32] LI XIN, MA XIAO-HUA, SU DONG, et al. Visualizzazione diretta dell'effetto Jahn-Teller accoppiato all'ordinamento del Na in Na5/8MnO2. Naz. Mater., 2014,13(6):586-592.
[33] WANG YOUWEI, WANG JUNKAI, ZHAO XIAOLIN, et al. Riduzione della tariffa sovrapotenziale delle batterie Li-O2 grazie al design del catodo con allineamento di banda. Energia e Scienze ambientali, 2020,13(8):2540-2548.
[34] ZHENG C, RADHAKRISHNAN B, CHU I H, et al. Effetti di miscelazione dei metalli di transizione sull'ordinamento del Na e cinetica degli ossidi P2 stratificati. Revisione fisica Applicato, 2017,7(6):064003.
[35] LUN ZHENG-YAN, OUYANG B, CAI ZI-JIAN, et al. Principi di progettazione per catodi di salgemma disordinato con cationi a base di Mn ad alta capacità. Chem, 2020,6(1):153-168.
[36] SEO D H, LEE J, URBAN A, et al. La struttura e origine chimica dell'attività redox dell'ossigeno in strati e disordinati cationi Materiali catodici con eccesso di litio. Naz. Chimica, 2016,8(7):692-697.
[37] BAI QIANG, YANG LU-FENG, CHEN HAI-LONG, et al. Studi computazionali dei materiali degli elettrodi nelle batterie agli ioni di sodio. Energia avanzata Materiali, 2018,8(17):1702998.