Il degrado di capacità nelle batterie agli ioni di litio è suddiviso in perdita di capacità reversibile e perdita di capacità irreversibile. La perdita di capacità reversibile è relativamente "lieve" e può essere parzialmente recuperata regolando i protocolli di carica-scarica (ad esempio, ottimizzando la corrente di carica, i limiti di tensione) e migliorando le condizioni di utilizzo (ad esempio, il controllo di temperatura/umidità). Al contrario, la perdita di capacità irreversibile deriva da cambiamenti irreversibili all'interno della batteria, che portano a una riduzione permanente della capacità. Secondo gli standard GB/T 31484-2015 per i test di durata del ciclo: "Durante i test di durata del ciclo standard, la capacità di scarica non deve scendere al di sotto del 90% della capacità iniziale dopo 500 cicli o dell'80% dopo 1.000 cicli". Se la batteria mostra un rapido declino della capacità entro questi intervalli di cicli standard, viene classificata come guasto per decadimento di capacità, che in genere coinvolge meccanismi di degradazione irreversibili.
I. Fattori correlati ai materiali
1. Degrado strutturale del materiale catodico
I materiali catodici subiscono complessi cambiamenti fisici e chimici durante i cicli di carica-scarica. Prendendo ad esempio il LiMn₂O₄ con struttura a spinello, la sua struttura si distorce a causa dell'effetto Jahn-Teller durante i cicli. Questa distorsione si accumula con cicli ripetuti e può infine causare la frattura delle particelle catodiche. Le particelle fratturate degradano il contatto elettrico tra le particelle, ostacolando il trasporto degli elettroni e riducendo la capacità. Inoltre, in alcuni materiali catodici si verificano transizioni di fase irreversibili e disordini strutturali. Ad esempio, sotto alta tensione, alcuni materiali catodici passano da strutture cristalline stabili a fasi sfavorevoli all'intercalazione/de-intercalazione degli ioni di litio, impedendo la mobilità degli ioni di litio e accelerando la perdita di capacità.
2. Crescita eccessiva di SEI sulle superfici degli anodi
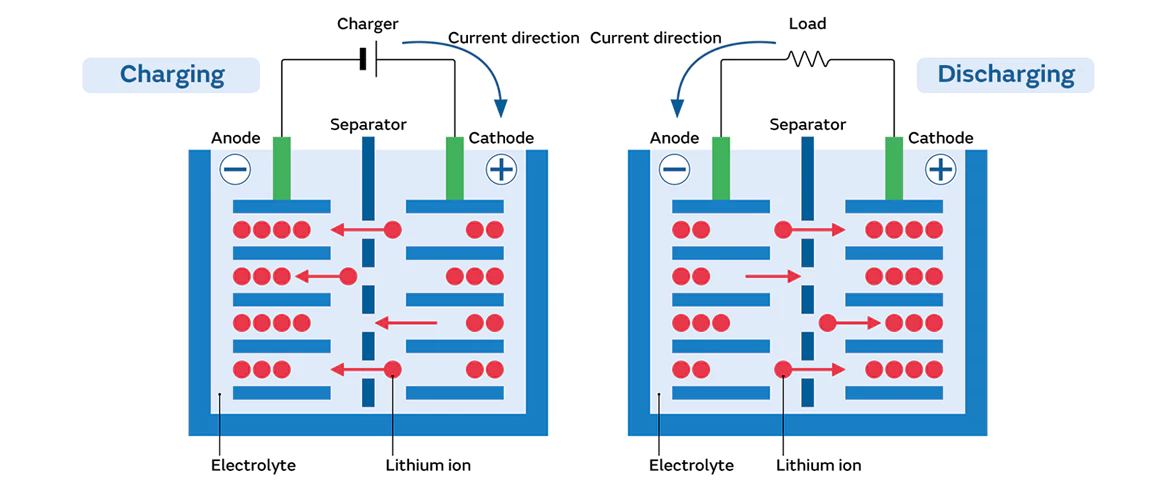
Per gli anodi in grafite, le interazioni tra la superficie e l'elettrolita sono critiche. Durante il processo di carica iniziale, i componenti dell'elettrolita subiscono reazioni di riduzione sulla superficie della grafite, formando uno strato di interfase elettrolitica solida (SEI). Normalmente, lo strato SEI è ionicamente conduttivo ma elettronicamente isolante, proteggendo l'anodo dalla continua corrosione dell'elettrolita. Tuttavia, un'eccessiva crescita di SEI pone problemi significativi. In primo luogo, la formazione di SEI consuma ioni di litio, riducendo la quantità di Li⁺ disponibile per i normali processi di carica-scarica e causando una perdita di capacità. In secondo luogo, le impurità dei metalli di transizione (ad esempio, derivanti dalla dissoluzione del catodo) depositate sulla superficie dell'anodo possono catalizzare un'ulteriore crescita di SEI, accelerando l'esaurimento del litio.
3. Decomposizione e degradazione degli elettroliti
L'elettrolita svolge un ruolo fondamentale nel trasporto degli ioni. I comuni sali di litio come il LiPF₆ presentano una scarsa stabilità chimica e si decompongono ad alte temperature o tensioni, riducendo la disponibilità di Li⁺ e generando sottoprodotti nocivi (ad esempio, il PF₅, che reagisce con i solventi). L'umidità presente nell'elettrolita reagisce con il LiPF₆ producendo acido fluoridrico (HF), un agente corrosivo che attacca i materiali del catodo/anodo e i collettori di corrente. Una scarsa sigillatura della batteria consente l'ingresso di umidità/ossigeno dall'esterno, accelerando l'ossidazione dell'elettrolita. Gli elettroliti degradati presentano una maggiore viscosità, scolorimento e una drastica riduzione della conduttività ionica, compromettendo gravemente le prestazioni della batteria.
4. Corrosione del collettore di corrente
I collettori di corrente (ad esempio, fogli di alluminio per i catodi, fogli di rame per gli anodi) raccolgono e conducono la corrente. I guasti includono corrosione e indebolimento dell'adesione. I meccanismi di corrosione includono:
5. Tracce di impurità nel sistema della batteria
Le impurità dei metalli di transizione (Fe, Ni, Co) introdotte tramite le materie prime possono partecipare alle reazioni redox, catalizzare la decomposizione degli elettroliti o competere con l'intercalazione di Li⁺. Queste impurità destabilizzano anche gli strati SEI, esacerbando le reazioni collaterali anodiche.
II. Fattori ambientali operativi
1. Effetti della temperatura
• Le alte temperature accelerano la decomposizione dell'elettrolita e la ristrutturazione del SEI. La degradazione del LiPF₆ genera PF₅, che reagisce con i solventi, mentre gli strati del SEI si ispessiscono formando film a predominanza inorganica con maggiore resistenza ionica. Ad esempio, i veicoli elettrici che operano in climi caldi presentano un decadimento accelerato della capacità.
2. Velocità di carica-scarica (velocità C)
Elevati tassi di carica (C-rate) durante la carica causano una deposizione irregolare del litio, formando dendriti che consumano Li⁺ e rischiano cortocircuiti interni. La scarica ad alta velocità aggrava la polarizzazione, riducendo l'energia utilizzabile e accelerando la perdita di capacità. Gli utensili elettrici che richiedono scariche frequenti ad alta corrente mostrano una durata della batteria ridotta.
3. Sovraccarica/scarica eccessiva
• La carica eccessiva provoca una delitazione eccessiva dei catodi, provocando il collasso strutturale e una violenta ossidazione dell'elettrolita (generazione di gas, rigonfiamento o fuga termica).• Scaricare eccessivamente gli anodi litiati, destabilizzandone la struttura e inducendo la riduzione dell'elettrolita. I primi smartphone privi di circuiti di protezione mostravano una rapida perdita di capacità in caso di tale abuso.
Conseguenze del guasto della batteria
Un grave degrado della capacità si manifesta con un tempo di funzionamento insufficiente (ad esempio, breve funzionamento del dispositivo dopo la ricarica) o un comportamento di ricarica anomalo (ad esempio, ricarica lenta). Nelle applicazioni critiche:
• Veicoli elettrici: un guasto della batteria riduce l'autonomia di guida e può lasciare i veicoli bloccati.• Accumulo di energia su scala di rete: le batterie difettose destabilizzano l'affidabilità dell'alimentazione elettrica, minacciando la sicurezza della rete.