Gel a doppio sale di litio Elettrolita complesso: preparazione e applicazione in pastella litio-metalloy
GUO Yuxiang, HUANG Liqiang, WANG Gang, WANG Hongzhi. Complesso gel a doppio sale di litio Elettrolita: preparazione e applicazione nella batteria al litio-metallo. Giornale di Materiali inorganici, 2023, 38(7): 785-792 DOI:10.15541/jim20220761
Astratto
Metallic Li è uno degli anodi ideali per gli ioni di litio ad alta densità di energia batteria grazie alla sua elevata capacità specifica teorica e al basso potenziale di riduzione così come abbondanti riserve. Tuttavia, l'applicazione degli anodi di litio ne risente grave incompatibilità con il tradizionale elettrolita liquido organico. Qui, a elettrolita complesso gel (GCE) con compatibilità soddisfacente con il litio metallico l'anodo è stato costruito tramite polimerizzazione in situ. Il doppio Il sistema di sali di litio introdotto nell'elettrolita può cooperare con componente polimerico, che amplia la finestra elettrochimica dell'elettrolita 5,26 V rispetto ai 3,92 V dell'elettrolita commerciale, e ottiene un'elevata ionizzazione conduttività di 1×10-3 S·cm-1 anche a 30 â. Risultati di caratterizzazione morfologica e analisi elementare della superficie dell'anodo di Li che GCE mostra un evidente effetto protettivo sul litio metallico ai sensi del condizione del sistema a doppio sale di litio, effetto volume e crescita dei dendriti dell'anodo di Li sono ovviamente inibiti. Allo stesso tempo, il litio metallico è pieno batteria, assemblata con materiale catodico commerciale al litio ferro fosfato (LiFePO4), mostra un'eccellente stabilità ciclistica e prestazioni di velocità. La capacità il tasso di ritenzione della batteria raggiunge il 92,95% dopo 200 cicli costanti corrente di 0,2 C (1 C = 0,67 mA·cm-2) a 25 â. Questo studio indica che il GCE può effettivamente migliorare la sicurezza, la stabilità e la globalità prestazioni elettrochimiche della batteria al litio-metallo, che si prevede fornire una strategia per la progettazione universale di elettroliti quasi-solidi.
Parole chiaveï¼ Li metallico; polimerizzazione in situ; complesso gel elettrolita
Da quando è stato fissato l'obiettivo "Double Carbon". Nel 2020 la Cina dovrà affrontare una riforma del sistema energetico senza precedenti. Cina deve completare una profonda riduzione delle emissioni di carbonio nei prossimi 30 anni, e l’energia verde si rafforzerà gradualmente fino a sostituire il “monopolio”. posizione dell’energia fossile tradizionale. Come una parte importante delle rinnovabili sistema energetico, la tecnologia delle batterie agli ioni di litio ha attratto diffusa attenzione una volta uscito. Allo stato attuale, oltre ad essere l'energia principale dispositivo di prodotti elettronici 3C, l'applicazione di batterie al litio nel settori dell’industria automobilistica, aerospaziale e delle reti intelligenti sta avvenendo gradualmente in aumento, il che impone requisiti più elevati per le sue prestazioni. In Per ottenere una maggiore autonomia di navigazione è necessario alimentare batterie al litio sviluppare un sistema di batterie con una maggiore densità di energia. Tra questi, il litio metallico con capacità specifica ultraelevata (3860 mAh g-1) e basso potenziale di riduzione (-3,04 V (rispetto a SHE)) dovrebbe diventare il materiale anodico per la prossima generazione di batterie ad alta densità di energia. Tuttavia, quando il litio metallico è in contatto con elettroliti liquidi organici, le reazioni collaterali continuano a verificarsi interfaccia, portando alla crescita incontrollabile dei dendriti di litio, perforando l'interfaccia separatore interno della batteria, causando cortocircuiti e persino sicurezza problemi. In risposta a questo difetto, di solito si ritiene che venga utilizzato solido elettrolita anziché elettrolita liquido per migliorare la sicurezza della batteria. Tuttavia, la sua conduttività ionica a bassa temperatura ambiente e la scarsa interfaccia la compatibilità ne ostacola seriamente l'ulteriore sviluppo e applicazione.
In questo contesto, gel-stato elettroliti in grado di bilanciare i contatti interfacciali e la conduttività ionica hanno ricevuto una crescente attenzione. Tan Shuangjie et al hanno sviluppato a elettrolita allo stato gel non infiammabile mediante immobilizzazione ritardante di fiamma organofosfati in una matrice polimerica di polivinilene carbonato ad alto contenuto resistenza meccanica. L'elettrolita presenta i vantaggi di un alto contenuto ionico conduttività e numero di trasferimento degli ioni di litio, non infiammabilità, elevata meccanica resistenza e buona compatibilità elettrochimica. Inoltre, il gel l'elettrolita formato all'interno della batteria mediante polimerizzazione in situ ha il caratteristiche di bassa viscosità, facile manipolazione e forte capacità bagnante, che può infiltrarsi completamente nei materiali attivi e produrre un'interfaccia ideale contatto, ottenendo così un buon percorso di migrazione ionica. Ad esempio, quello di Guo Yuguo gruppo di ricerca ha mescolato il tradizionale monomero a base etere 1,3-dioxolane (1,3-dioxolane, DOL) con 1,2-dimetossietano (1,2-dimetossietano, DME), litio commerciale L'esafluorofosfato (LiPF6) come sale di litio può innescare l'apertura dell'anello polimerizzazione del DOL allo stesso tempo e un nuovo elettrolita allo stato gel può funzionare stabilmente nelle batterie al litio-zolfo e nelle batterie catodiche commerciali è stato ottenuto. Sebbene il polimero a base di polietere sia uno dei più stabili elettroliti per anodi di litio metallico, la sua stretta finestra elettrochimica e la bassa conduttività ionica a temperatura ambiente ne limita l'applicazione ad alta energia batterie a densità Sebbene LiPF6 abbia una conduttività ionica ideale ed eccellente compatibilità degli elettrodi, presenta il problema della scarsa stabilità elettrochimica. Pertanto, per sviluppare un elettrolita allo stato gel con eccellente completezza prestazioni, è necessario selezionare gli ospiti polimerici adatti, i sali di litio e altri componenti.
Per bilanciare la relazione tra conduttività, stabilità all'alta tensione e compatibilità degli elettrodi, a In questo studio è stato sviluppato il GCE composito solido-liquido ad alte prestazioni. IL è stato adottato il metodo di polimerizzazione in situ avviato termicamente, è stato utilizzato PEGDA come monomero era un solvente misto di carbonato di etilene e carbonato di dietile aggiunto e LiTFSI e LiDFOB sono stati introdotti come sistema a doppio sale di litio per lavorare insieme ai componenti polimerici. Migliorando nel contempo il prestazioni elettrochimiche, stabilità dell'interfaccia tra l'elettrolita e l'anodo di litio metallico è ulteriormente potenziato.
1 Metodo sperimentale
1.1 Preparazione del GCE
LiTFSI, LiDFOB, EC e DEC (Suzhou Duoduo Chemical Technology Co., Ltd.) sono tutti materiali per batterie di grado anidro. IL I reagenti EC e DEC sono stati miscelati e LiTFSI e LiDFOB sono stati pesati e pesati disciolto nel solvente. L'elettrolita del sistema a doppio sale preparato (Liquid Elettrolita, LE) era una soluzione EC/DEC (rapporto volumetrico 1:1) di 1 mol/L di LiTFSI e 0,2 mol/L LiDFOB. PEGDA (±99%, Mn=400) e azobisisobutirronitrile (Azodiisobutyronitrile, AIBN, 98%) sono stati acquistati da Shanghai Aladdin Reagent Co., Ltd. La soluzione precursore di GCE è stata preparata mescolando PEGDA e LE, e la frazione di massa di PEGDA era del 10%, 20% e 30%. Aggiungere l'1% della frazione di massa di iniziatore termico AIBN e mescolare bene. La soluzione del precursore PEGDA è stata riscaldata a 70 ℃ per 2 ore per ottenere un gel composito a base PEGDA completamente polimerizzato elettroliti, denominati GCE-x (x=10, 20, 30). Gli esperimenti di cui sopra erano il tutto effettuato in una guantiera anidra e priva di ossigeno.
1.2 Assemblaggio della batteria
Gruppo batteria della pila a bottone CR2025 (316 acciaio inossidabile, SS), lamiera di litio (14 mm×0,45 mm, Li), foglio di alluminio (grado della batteria). In base ai diversi requisiti di test, batterie SS||SS, Sono state assemblate batterie Li||SS, batterie Li||Li e batterie Li||LiFePO4 il vano portaoggetti. Il rapporto in massa di LiFePO4, Ketjen Black e Polivinilidene Il difluoruro (PVDF) nel materiale del catodo è 90: 5: 5 e la capacità areale è 0,67 mAh·cm-2. Vedere il materiale supplementare S1 per i dettagli sulla preparazione processo del foglio dell'elettrodo positivo e processo di assemblaggio della batteria.
1.3 Metodi di caratterizzazione dei materiali
I gruppi funzionali e chimici le strutture dei monomeri PEGDA e dei loro polimeri sono state analizzate utilizzando un Thermo Spettrometro a infrarossi in trasformata di Fourier NiColet iS50 (Trasformata di Fourier Spettrometro a infrarossi, FT-IR) della Thermo Fisher Scientific Corporation del Stati Uniti, con una gamma di lunghezze d'onda di 400-4000 cm-1. La cristallinità di gli elettroliti allo stato gel con diversi contenuti polimerici erano caratterizzati da un diffrattometro a raggi X D2 Phaser (diffrattometro a raggi X, XRD) di Bruker AXS Company, Germania, e il raggio di scansione era di 2θ=5°~80°. Il contatto OCA40Micro strumento di misurazione dell'angolo di Pechino Dongfang Defei Instrument Co., Ltd. era utilizzato per testare l'angolo di contatto delle soluzioni precursori con diversi PEGDA contenuto sulla superficie del foglio di elettrodi LiFePO4. La morfologia microscopica della sezione trasversale e della superficie della lamiera di litio è stata osservata da a Microscopio elettronico a scansione a emissione di campo JElectronics JSM-7500F (Field Microscopio elettronico a scansione a emissione, FESEM). Le informazioni elementari su La superficie della lamiera di litio è stata analizzata utilizzando un sistema a raggi X Escalab 250Xi spettrometro fotoelettronico (spettroscopia fotoelettronica a raggi X, XPS) di Thermo Fisher Scientific Corporation degli Stati Uniti.
1.4 Test elettrochimico
La finestra di stabilità elettrochimica del l'elettrolita è stato testato mediante voltammetria a scansione lineare (LSV), l'intervallo di tensione era dalla tensione a circuito aperto (OCV) a 6 V e la velocità di scansione era di 1 mV·s-1. IL la gamma di frequenza della spettroscopia di impedenza elettrochimica (EIS) è 10-2 ~ 106 Hz, e la tensione di perturbazione è 10 mV. Per la misurazione è stata utilizzata la cronoamperometria il numero di migrazione degli ioni di litio nell'elettrolita, il potenziale la differenza è stata impostata su 10 mV, il tempo era 800 s e il numero di migrazione di ioni litio è stato ottenuto secondo la formula (1):
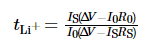
Tra questi, tLi+ è il numero di trasferimento di ioni di litio, ÎV è la differenza di potenziale, R0 e RS sono l'interfaccia valori di impedenza dell'elettrodo e dell'elettrolita prima e dopo il test, rispettivamente, e I0 e IS sono lo stato iniziale attuale e stazionario corrente, rispettivamente. I test di cui sopra sono stati tutti eseguiti sul PARSTAT MC stazione di lavoro elettrochimica multicanale di AMETEK, USA. Le prestazioni del ciclo di carica-scarica di la batteria è stata testata utilizzando la piattaforma di test per batterie LAND CT3001A-1U di Wuhan Landian Electronics Co., Ltd.
2 Risultati e discussione
2.1 Preparazione e analisi strutturale del GCE
In questo studio, PEGDA è stato utilizzato come monomero, AIBN è stato utilizzato come iniziatore della polimerizzazione e sono stati introdotti EC e DEC come plastificanti. Un elettrolita allo stato gel con un polimero reticolato il polietilenglicole dimetacrilato (p(PEGDA)) è stato sintetizzato a 70 â. IL la formula della reazione di polimerizzazione è mostrata nella Figura 1 (a). Dopo aver aggiunto il iniziatore termico AIBN, PEGDA con due gruppi C=C terminali attivi rapidamente subisce omopolimerizzazione intermolecolare quando riscaldato a 70 °C. L'attivo le catene di AIBN fanno sì che le catene molecolari si connettano tra loro o internamente, e infine ottenere la struttura scheletrica della rete p(PEGDA), e con successo utilizzare il metodo di polimerizzazione in situ per ottenere l'elettrolita allo stato gel all'interno della batteria. Come mostrato nella Figura S1, le tre soluzioni precursori con diversi contenuti di PEGDA hanno mostrato tutti una buona bagnabilità sul positivo LiFePO4 foglio di elettrodi, che è la chiave per ottenere un buon contatto interfacciale tra l'elettrolita e l'elettrodo.
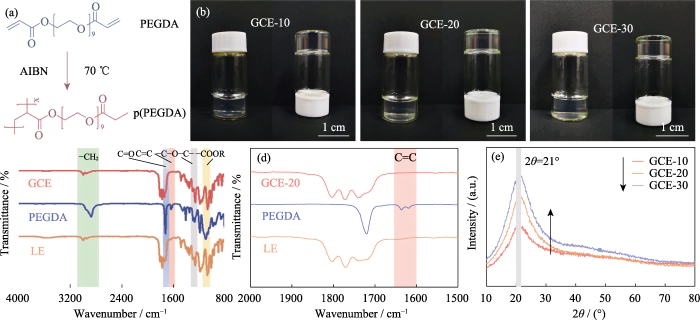
Fig. 1 Preparazione e analisi strutturale del GCE
(a) Polimerizzazione reazione di PEGDA; (b) Fotografie ottiche di GCE-x; (c, d) FT-IR spettri di GCE-20, PEGDA e LE; (e) modelli XRD di GCE-x; Colorato i dati sono disponibili sul sito web
Per ottenere GCE ad alto contenuto ionico conduttività, LiTFSI, che ha un alto grado di dissociazione nel polimero, è stato utilizzato come sale di litio e per la costruzione sono stati introdotti 0,2 mol/L di LiDFOB la rete di gel del sistema a doppio sale. LiDFOB ha una buona solubilità e stabilità termica, soprattutto nelle proprietà filmogene. Quando carbonato i solventi sono in contatto con gli anodi metallici di litio, un gran numero di sciolti è probabile che si formino strati di deposizione di litio porosi o dendritici superficie del litio metallico. L'introduzione di LiDFOB può aiutare nella formazione dell'interfase dell'elettrolita solido privo di HF (Elettrolita Solido Strato interfase, SEI) e migliorare la compatibilità con gli anodi metallici di litio. Allo stesso tempo, LiTFSI ha un effetto corrosivo sui collettori di corrente metallici, mentre LiDFOB può passivare il metallo di alluminio e alleviare l'effetto della corrosione LiTFSI sugli attuali collettori. Tuttavia, l'elettrolita a sale singolo di LiDFOB ha mostrato un'impedenza più elevata rispetto all'elettrolita a doppio sale LiTFSI-LiDFOB del stessa concentrazione. Come mostrato nella Figura S2, la batteria Li||LiFePO4 era assemblato utilizzando elettroliti in gel LiDFOB e LiTFSI-LiDFOB da 1,2 mol/L, rispettivamente, e l'impedenza della batteria LiTFSI-LiDFOB era significativamente più piccolo.
I risultati della ricerca esistente mostrano che LiTFSI e LiDFOB possono avere un effetto sinergico, migliorando efficacemente la compatibilità dell'elettrolita con l'anodo di litio metallico. Jiao Shuhong et al. ha utilizzato XPS e FT-IR per scoprire che l'elettrolita a doppio sale di LiTFSI e LiDFOB può passivare il collettore di corrente in alluminio dell'elettrodo positivo e formare uno strato SEI stabile sulla superficie del negativo al litio metallico elettrodo per ottenere un ciclo stabile a lungo termine delle batterie al litio metallico. SU questa base, Liu Yue et al. [26] hanno utilizzato la simulazione della dinamica molecolare ibrida studiare il meccanismo di azione congiunta di LiTFSI e LiDFOB nel litio metallico batterie e ha spiegato l'effetto protettivo di LiTFSI su LiDFOB. Studi hanno dimostrato che il legame BO di LiDFOB è relativamente il più debole e incline a rottura. LiDFOB si decomporrà rapidamente sotto l'azione dei radicali liberi e reagiscono con il litio metallico per produrre atomi di Li0 e boro liberi. L'atomo di boro la reazione di inserimento fa sì che le molecole di solvente nell'elettrolita si avvicinino si decompongono e i frammenti molecolari risultanti continueranno a reagire frammenti molecolari di sale di litio e atomi di boro. Nel sistema dei sali di dilitio, tuttavia, LiTFSI si decompone preferenzialmente, facendo affidamento sul "sacrificio meccanismo" per proteggere LiDFOB, il tasso di decomposizione di LiDFOB è significativamente ridotto. Riducendo così il numero di atomi di Li0 e boro liberi, che può ottimizzare lo strato SEI e proteggere l'anodo metallico di litio.
Come mostrato nella Figura 1(b), GCE-x è uniforme e trasparente, gelatinoso, non più fluido. Per verificare ulteriormente il monomero polimerizzazione, FT-IR è stato utilizzato per caratterizzare le strutture chimiche di LE, Monomero PEGDA e GCE-20. Come mostrato in Fig. 1 (c), tutti e tre i campioni mostrano il tipico picco di assorbimento della vibrazione di stiramento C=O (~1726 cm-1). IL il picco di assorbimento a 1280 cm-1 di GCE corrisponde all'antisimmetrico e picchi di stiramento simmetrici del legame etereo, indicando che -(CH2CH2)n- in il monomero non viene distrutto durante la polimerizzazione. I picchi a 1095 e 2867 cmâ1 appartengono rispettivamente a -COOR e -CH2. COME mostrato nella Figura 1 (d), il picco caratteristico del legame C = C di PEGDA è situato a 1616-1636 cm-1, ma scompare in GCE, indicando che PEGDA ha stato polimerizzato completamente.
Poiché gli ioni di litio migrano solo nel regione amorfa del GCE, riducendo la cristallinità dell'elettrolita utile per migliorare la conduttività ionica. La Figura 1 (e) è il modello XRD di GCE-x. I tre tipi di campioni hanno tutti un picco di assorbimento della diffrazione unico a 2θ=21°, indicando che l'elettrolita preparato ha una regione amorfa accompagnato da una piccola quantità di cristalliti. Come il contenuto di PEGDA aumenta, l'area del picco dello spettro aumenta in modo significativo, il la proporzione della regione amorfa dell'elettrolita gel diminuisce e il il contenuto di componenti amorfi nell'elettrolita diminuisce, ma non è così favorevole alla migrazione degli ioni.
2.2 Prestazioni elettrochimiche di GCE e Analisi di compatibilità del metallo Li
Per studiare la compatibilità di elettroliti con diverso contenuto di polimero con anodi di litio metallico batterie, gli spettri di impedenza delle batterie Li||Li simmetriche con GCE-x sono stati analizzati gli elettroliti nello stato iniziale (come mostrato nella Figura S3). Nel figura, sono i valori di impedenza dell'interfaccia delle batterie GCE-10 e GCE-20 entrambi piccoli, rispettivamente 93 e 152 Ω, e la batteria GCE-30 arriva a 409 Ω. Mostra che la migrazione degli ioni di litio nel GCE con un contenuto di polimeri più elevato richiede per superare una barriera migratoria più grande, che non è favorevole alla rapida conduzione degli ioni di litio all'interfaccia.
Osservando la sovratensione del Li||Li batteria simmetrica nel test del ciclo di carica-scarica, possiamo conoscere il potenziale differenza generata dalla migrazione della coppia ionica durante questo processo, e poi valutare il comportamento di deposizione/stripping del litio. La Figura S4 mostra il curve tensione-tempo della cella simmetrica Li||Li di GCE-x. La temperatura di prova era di 25 â e la batteria veniva caricata e scaricata con una corrente costante con una capacità specifica di 0,5 mAh cm-2 e una densità di corrente di 0,5 mA cm-2. Il sovrapotenziale iniziale delle celle Li|GCE-10|Li era di 22 mV e la tensione aumentato a 137 mV dopo 250 h. Il sovrapotenziale del GCE-30 simmetrico la batteria era di 104 mV nella fase iniziale e il sovrapotenziale aumentava rapidamente i cicli successivi, raggiungendo un valore di picco di 509 mV in 227 h e poi è sceso bruscamente, indicando che la batteria aveva un cortocircuito interno. In Al contrario, la batteria GCE-20 può funzionare con un basso sovrapotenziale vicino a 30 mV e ha le prestazioni elettrochimiche più stabili. Di seguito si concentrerà l'attenzione l'elettrolita GCE-20.
La conduttività ionica di un elettrolita riflette direttamente la capacità degli ioni di migrare in un campo elettrico. IL la conduttività ionica di LE e GCE-20 è stata testata a 60, 50, 40, 30, 20, 10 e 0 â, rispettivamente. Come mostrato nella Figura 2 (a), la conduttività ionica di GCE-20 a 30 °C corrispondono a 1,00 mS cm-1 e quando la temperatura del test sale a 60 °C, la conduttività raggiunge 1,39 mS cm-1. Questo perché l'energia di attivazione diminuisce con l'aumento della temperatura di prova e l'attività di movimento del segmenti della catena polimerica e aumento degli ioni di litio. Tuttavia, la velocità di movimento dei segmenti della catena polimerica è ovviamente influenzato dalla temperatura, quindi il la conduttività dell'elettrolita gel GCE-20 cambia più di quella dell'elettrolita soluzione.
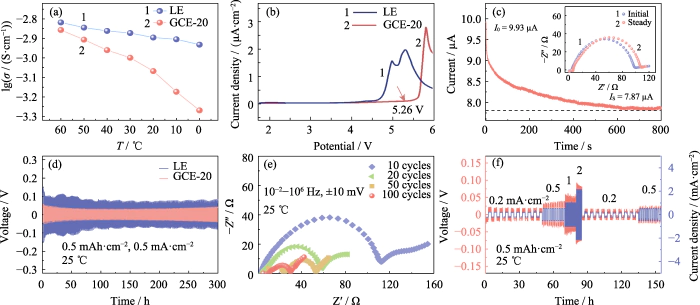
Fig. 2 Prestazioni elettrochimiche di GCE-20
(a) ionico conduttività di LE e GCE-20; (b) curve LSV di LE e GCE-20; (C) Profilo del tempo corrente della cella Li|GCE-20|Li con riquadro che mostra la corrispondenza Trame di Nyquist; (d) Curve tensione-tempo di celle Li||Li simmetriche assemblate con LE e GCE-20; (e) Grafici di Nyquist della cella Li | GCE-20 | Li dopo il ciclismo; (F) Curve tensione-tempo e densità di corrente-tempo della cella Li|GCE-20|Li; Colorato i dati sono disponibili sul sito web
Migliorare la densità energetica delle batterie richiede di garantire la stabilità dell'elettrolita a tensioni operative elevate. Gli studi hanno dimostrato che gli elettroliti a base di polimeri coordinati dal carbonile di solito hanno un'ampia finestra elettrochimica e una buona stabilità ad alte prestazioni tensioni. La Figura 2(b) mostra che la curva LSV della batteria GCE-20 inizia a fluttuano significativamente a 5,26 V, e si può considerare che il la finestra elettrochimica dell'elettrolita gel GCE-20 raggiunge 5,26 V. In Al contrario, la finestra elettrochimica dell'elettrolita commerciale è solo 3,92 V. Pertanto, l'elettrolita allo stato gel ha un'eccellente stabilità elettrochimica ad alta tensione.
Inoltre, la migrazione degli ioni di litio il numero dell'elettrolita è anche uno degli indicatori per misurare il litio conduttività ionica. È definito come il rapporto tra il numero di ioni di litio passando attraverso una sezione dell'elettrolita perpendicolare alla direzione di migrazione degli ioni di litio per unità di tempo alla somma degli anioni e dei cationi che passano attraverso la sezione. Maggiore è il valore, maggiore è la percentuale di litio ioni nel processo di migrazione ionica e maggiore è l'efficienza della migrazione. La Figura 2(c) è la curva cronoamperometrica della batteria Li|GCE-20|Li, dove l'inserto è il confronto dell'impedenza elettrochimica della batteria prima e dopo la prova. Secondo la formula (1), il numero di migrazione degli ioni di litio del GCE-20 è 0,21. L'introduzione di additivi o il drogaggio con sostanze inorganiche i riempitivi possono ottenere un tasso di migrazione degli ioni di litio più elevato, e non solo utile per migliorare la velocità di carica e scarica della batteria, ma anche migliorare la stabilità del suo ciclo.
Durante il processo di carica e scarica della batteria simmetrica Li||Li, vengono sottoposti gli anioni e i cationi presenti nell'elettrolita contro-immigrazione. Durante la ricarica, gli ioni di litio migrano verso il negativo elettrodo e gli anioni migrano verso l'elettrodo positivo, e avviene il contrario vero durante lo scarico. Pertanto, durante il processo di carica e scarica, il gradiente di concentrazione degli ioni tra gli elettrodi positivo e negativo e il campo elettrico incorporato aumenta gradualmente, ostacolando il movimento opposto di anioni e cationi, con conseguente polarizzazione della concentrazione all'interno del batteria, con conseguente variazione di sovrapotenziale. Come mostrato nella Figura 2 (d), il La batteria Li|GCE-20|Li ha un sovrapotenziale di 46 mV dopo un ciclo stabile per 300 H. Tuttavia, il sovrapotenziale generato dalla batteria Li|LE|Li durante il test è significativamente superiore a quello della batteria Li|GCE-20|Li (65~118 mV). Questo è perché i dendriti di litio in crescita causano in alcuni casi lievi cortocircuiti siti interni. I risultati mostrano che il comportamento elettrochimico all'interno del La batteria GCE-20 è più ideale. La Figura 2 (e) è il test EIS del simmetrico batteria dopo 10, 20, 50 e 100 cicli. Come il numero di carica-scarica cicli aumenta, l'impedenza della batteria tende a diminuire. Durante questo processo, uno strato SEI stabile è stato costruito tra l'elettrolita e il litio metallico interfaccia e il contatto dell'interfaccia è stato ottimizzato, in modo che l'interfaccia l'impedenza è diminuita significativamente.
A 25 â, la batteria Li|GCE-20|Li era sottoposto a 10 cicli di carica-scarica con densità di corrente di 0,2, 0,5, 1, 2, 0,2 e 0,5 mA cm-2, rispettivamente. La Figura 2(f) riflette la tendenza del sovrapotenziale della cella simmetrica nel tempo durante questo processo. IL la sovratensione a bassa densità di corrente è piccola e può rimanere relativamente stabile. Dopo che la densità di corrente aumenta, la sovratensione aumenta di conseguenza, e non si verifica alcun aumento/diminuzione improvviso della tensione durante il processo.
La morfologia del rivestimento in lamiera di litio dopo il ciclismo è possibile caratterizzare visivamente il comportamento di deposizione/rimozione di litio all'interno della batteria. La batteria simmetrica Li||Li è stata successivamente smontata carica e scarica per 100 ore con una capacità di 0,5 mAh cm-2 e una corrente densità di 0,5 mA cm-2 e la morfologia microscopica della sezione trasversale e la superficie della lamiera di litio è stata osservata mediante FESEM. Come mostrato nella Figura 3(a, b), lo spessore del foglio di litio puro non trattato è 353 µm e la superficie è piana e liscia. L'interazione tra l'elettrolita liquido e il litio metallico porta alla deposizione di un gran numero di elementi sciolti e porosi strati di deposizione di litio sulla superficie del foglio di litio del Li|LE|Li batteria, per lo più sotto forma di muschio fine e irregolare. Quando lo spessore del la lamiera di litio aumenta a 446 Âμm, si nota un'evidente espansione di volume effetto e viene generato un gran numero di dendriti. Al contrario, il lo spessore del foglio di litio nella batteria Li|GCE-20|Li è 391 μm e il lo strato di deposizione superficiale è denso e uniforme e non è suddiviso finemente rivestimento al litio (Fig. 3 (c)). Mostra che l'elettrolita allo stato gel può sopprime efficacemente l'espansione del volume dell'anodo metallico di litio. LiDFOB dentro GCE-20 può aiutare nella formazione di uno strato SEI stabile per bilanciare l'interno potenziale della batteria e ritardare la crescita dei dendriti di litio inducendo deposizione uniforme di litio. Pertanto, in una certa misura, può ottimizzare il comportamento di deposizione/rimozione del litio e proteggere l'anodo di litio metallico.

Fig. 3 Immagini SEM del Li metallico
Sezione trasversale (in alto) e immagini SEM con vista dall'alto (in basso) di (a) nuova deposizione di litio metallico e litio morfologia in cellule Li||Li simmetriche con (b) LE e (c) GCE-20
Successivamente analisi degli elementi superficiali in XPS è stato utilizzato per esplorare la composizione dello strato SEI sulla superficie del anodo di litio metallico sotto l'azione del sistema a doppio sale LiTFSI-LiDFOB GCE. La Figura S5 è lo spettro XPS della superficie dell'anodo metallico di litio utilizzando LE e GCE-20. Lo spettro di C1 (Fig. S5(a, d)) ha principalmente 4 picchi di segnale, corrispondente a C-C/C-H a 284,8 eV. I due picchi a 286,4 e 289,4 eV corrispondono rispettivamente a C-O e C=O e derivano principalmente da prodotti di decomposizione di solventi carbonatici (come ROCO2-, ROC-, ecc.). IL il picco a 292,7 eV corrisponde a CF3, che deriva principalmente da prodotti di decomposizione dei sali di litio. Nello spettro O1s (Figura S5(b, e)), i picchi a 531,1 e 532,3 eV corrispondono rispettivamente a C=O e C-O, e il contenuto relativo di C-O è significativamente ridotto, il che è principalmente correlato alla diminuzione del contenuto dei prodotti di decomposizione. Sotto l'articolazione azione di LiTFSI e LiDFOB, la formazione di LiOCH3, Li2O2C2H4 e altri sottoprodotti è limitato. Inoltrezione, a differenza di LE (Fig. S5(e)), nelle F1 spettro di GCE-20 (Fig. S5 (f)), il picco del segnale di LiF è a 684,5 eV e LiF può aiutare nella formazione di uno strato SEI denso e stabile.
2.3 Analisi delle prestazioni elettrochimiche di Batteria Li||LiFePO4
LiFePO4 presenta i vantaggi dell'alto capacità, ciclo di vita lungo e sicurezza eccezionale, ed è un aspetto positivo tradizionale materiale attivo dell'elettrodo. La sua capacità specifica teorica è di 170 mAh·g-1. A 25 â, la batteria Li|GCE-20|LiFePO4 è stata caricata e scaricata 200 volte alla volta corrente costante di 0,2C (1C=0,67 mA·cm-2). Come mostrato nella Figura 4 (a, b), il la capacità specifica di scarica del primo ciclo è 141,4 mAh·g-1. Lo scarico la capacità specifica del 200° giro è 131,4 mAh·g-1, il mantenimento della capacità la velocità raggiunge il 92,95% e il decadimento della capacità a giro singolo è inferiore allo 0,04%. IL la tensione della piattaforma è stabile, in linea con le caratteristiche di LiFePO4 batterie. Efficienza Coulombiana, come indicatore importante per valutare la batteria stabilità del ciclo, si riferisce al rapporto tra la capacità di scarica della batteria e quella di carica capacità durante lo stesso ciclo. L'efficienza coulombiana del primo ciclo La batteria Li|GCE-20|LiFePO4 è al 97,8%. A causa della formazione dello strato SEI durante il processo di scarica del primo ciclo, parte della capacità irreversibile viene scaricata generato, con conseguente bassa efficienza coulombiana del primo ciclo.
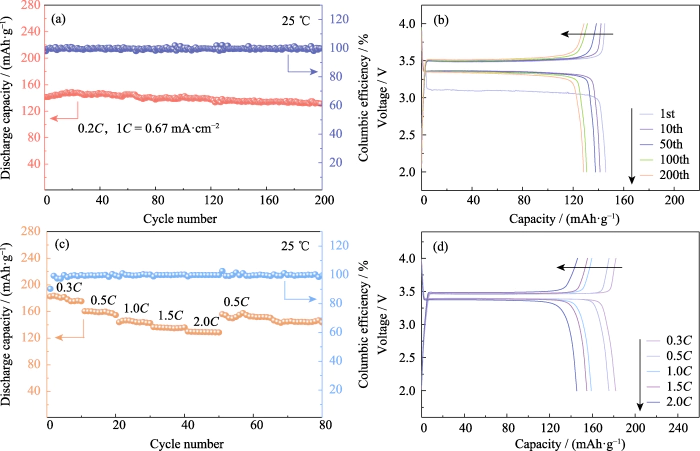
Fig. 4 Prestazioni elettrochimiche del Celle Li|GCE-20|LiFePO4
(a) Ciclismo prestazioni e (b) corrispondenti curve tensione-capacità a 0,2C; (C) Prestazioni tariffarie e (d) corrispondenti curve tensione-capacità; Colorato i dati sono disponibili sul sito web
Inoltre, test di carica e scarica sono stati eseguiti su Li|GCE-20|LiFePO4 a velocità di 0,3°C, 0,5°C, 1°C, 1,5°C e 0,5°C correnti per esplorare la sua performance tariffaria. Come mostrato in Fig. 4(c), quando il la velocità di corrente è 0,5°C, la capacità specifica di scarica del primo ciclo la batteria è da 160,2 mAh·g-1. All'aumentare del tasso attuale, la portata specifica la capacità della batteria diminuisce entro un intervallo controllabile. Il tasso è aumentato a 2C e la capacità specifica del primo ciclo dla tariffa è 130 mAh·g-1. Successivamente, il tasso attuale è tornato nuovamente a 0,5°C, e il la capacità specifica della scarica del primo ciclo era di 156,1 mAh·g-1. Il rilevante le curve tensione-capacità sono mostrate nella Figura 4 (d). La tensione di plateau a tassi diversi sono stabili senza causare un aumento del sovrapotenziale e il la batteria mostra buone prestazioni di velocità e reversibilità.
3 Conclusione
GCE basato su PEGDA è stato sviluppato da Thermally avviando la polimerizzazione in situ. L'analisi di caratterizzazione FT-IR e XRD di GCE, combinato con test elettrochimici, ha selezionato il GCE ottimale formulazione. Assemblare ulteriormente la batteria per studiare l'elettrochimica prestazioni dell'elettrolita e analizzare l'effetto protettivo del elettrolita sull'elettrodo negativo al litio metallico osservando il morfologia microscopica e caratterizzazione degli elementi superficiali del litio metallico, spiegando:
1) Il GCE-x (x=10, 20, 30) preparato da la polimerizzazione in situ può bagnare bene il foglio dell'elettrodo e l'elettrolita ha la migliore stabilità elettrochimica quando la frazione di massa di PEGDA è del 20%.
2) Il sistema dei sali di dilitio di LiTFSI e Viene introdotto LiDFOB, che può formare una buona interazione con il polimero componenti. L'elettrolita ha una finestra elettrochimica ampia (5,26 V) ed elevata conduttività ionica (30 â, 1Ã10-3 S·cm-1). Allo stesso tempo, il sale di dilitio il sistema può essere utilizzato per costruire uno strato SEI stabile e proteggere efficacemente il anodo di litio metallico.
3) Utilizzo di GCE-20 per abbinare lo spot pubblicitario Materiale catodico LiFePO4, la batteria completa assemblata può caricarsi stabilmente e scarica per 200 cicli a una corrente di 0,2 C, con un tasso di mantenimento della capacità del 92,95% e mostra una buona prestazione tariffaria.
In sintesi, questo lavoro ha ottenuto un successo sicuro e eccellenti prestazioni elettrochimiche di GCE, che fornisce un efficace soluzione per lo sviluppo di litio ad alta densità energetica sicuro e stabile batterie metalliche.
Materiale aggiuntivo:
Processo di preparazione della batteria S1
Mescolare e macinare LiFePO4, Ketjen Black e PVDF secondo il rapporto target, aggiungere il solvente N-metilpirrolidone (N-metilpirrolidone, NMP), mescolare e disperdere completamente e ottenere un composto uniforme e impasto viscoso di materiale attivo. L'impasto liquido veniva raschiato e depositato sull'alluminio foglio con una spalmatrice piana, quindi trasferito in un forno sotto vuoto ed essiccato a 80 °C per 12 ore Dopo aver tagliato il foglio dell'elettrodo, asciugarlo nuovamente e trasferirlo su un vano portaoggetti anidro e privo di ossigeno.
Una guarnizione, una scheggia e una lamiera di litio sono stati posizionati al centro della custodia dell'elettrodo negativo in sequenza, e il lo spessore della lamiera di litio era di 0,35 mm. Successivamente, il precursore la soluzione di GCE è stata aggiunta goccia a goccia al centro della superficie del negativo elettrodo (50 µ l) utilizzando una pistola pipetta, quindi la batteria Celgard 2500 separatore e il foglio dell'elettrodo positivo (separatore della batteria Celgard 2500) sono stati messi in sequenza. Prima di assemblare la batteria Li||LiFePO4, il è stata pesata l'espansione polare positiva ed è stato registrato il carico di materiale attivo. Il carico superficiale del materiale attivo dell'elettrodo positivo LiFePO4 era 3,94 mg cm-2. Infine, pressurizzare e sigillare la batteria su una macchina sigillatrice per batterie, trasferirlo in un ambiente a 70 ° C e riscaldarlo per 2 ore per iniziare polimerizzazione per ottenere un elettrolita allo stato gel. Al fine di garantire che il l'elettrolita si infiltra completamente nell'espansione polare LiFePO4, la batteria deve esserlo lasciato riposare per 1 ora dopo l'assemblaggio.
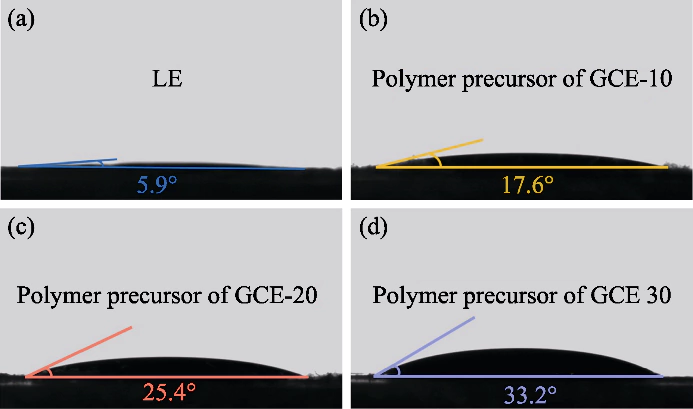
Fig. S1 Angoli di contatto tra la soluzione del precursore polimerico e i catodi
(a) LE; (b) GCE-10; (c) GCE-20; (d) GCE-30
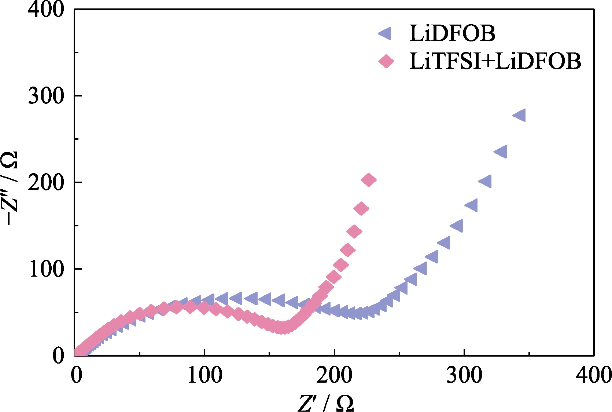
Fig. S2 Grafici Nyquist di celle Li||LiFePO4 assemblate GCE con diversi sali di litio
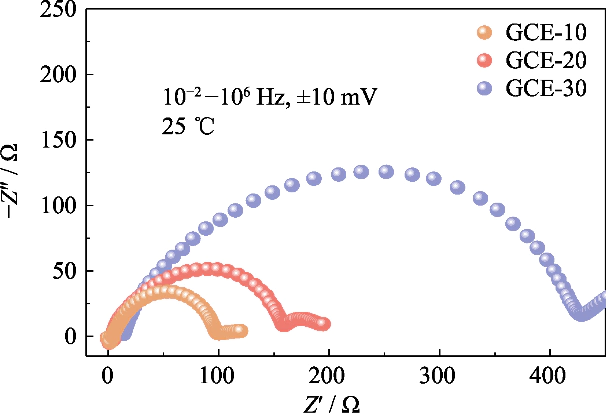
Fig. Grafici S3 Nyquist di celle Li||Li simmetriche assemblate con elettroliti GCE-x
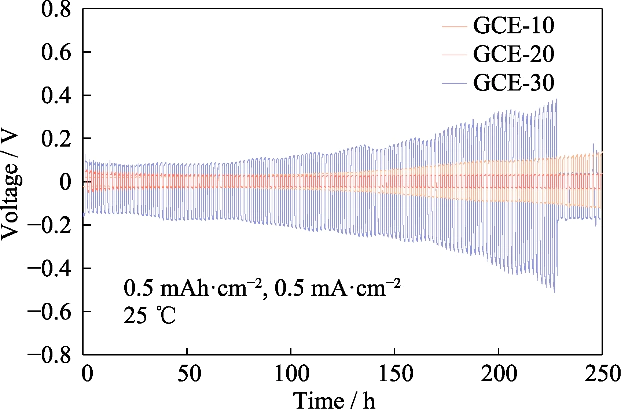
Fig. S4 Profili Vtensione-tempo di celle Li||Li simmetriche assemblate con elettroliti GCE-x
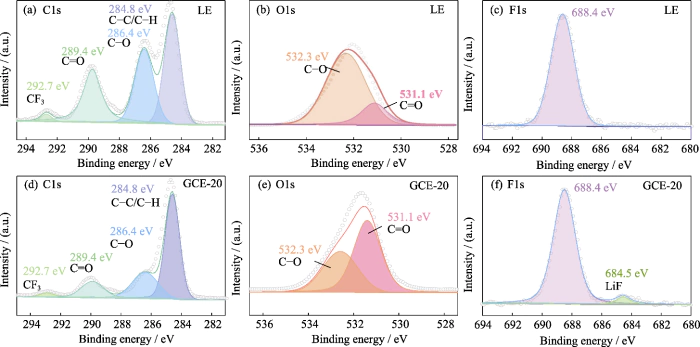
Fig. S5 XSpettri PS dell'anodo di Li metallico in celle Li||Li simmetriche
(a, d) C1s, (b, e) O1s, (c, f) F1s Spettri XPS dell'anodo di litio metallico con (a-c) LE e (d-f) GCE-20
[1] GOODENOUGH J B, KIM Y.
Sfide per batterie al litio ricaricabili
Chimica di Materiali, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F, et al.
Fluorurazione superficiale di materiali reattivi anodici della batteria per una maggiore stabilità
Giornale del American Chemical Society, 2017, 139(33):11550.
[3] TARASCON J M, ARMAND M.
Problemi e sfide di fronte alle batterie al litio ricaricabili
Natura, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G, et al.
Solido artificiale Interfase elettrolitica per sistemi acquosi di accumulo di energia al litio
Progressi scientifici, 2017, 3(9):e1701010.
[5] GIU K, DOM Y, XIAO Y, et al.
Litio superionico conduttori con strutture con condivisione degli angoli
Materiali naturali, 2022, 21: 924.
[6] LIU J, BAO Z, CUI Y, et al.
Percorsi per pratiche batterie al litio metallico ad alta energia e a ciclo lungo
Energia della natura, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J M.
Energia elettrica stoccaggio per la rete: una batteria di scelte
Scienza, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A, et al.
Costruire meglio batterie allo stato solido: una recensione
Materiali, 2019, 12(23):3892.
[9] MANTHIRAM A, YU X, WANG S.
Batteria al litio chimiche abilitate dagli elettroliti allo stato solido
Recensioni sulla natura Materiali, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, et al.
Elettroliti polimerici per le batterie al litio: avanzamenti e prospettive
Chem, 2019, 5(9):2326.
[11] TAN S J, YUE J, TIAN Y F, et al.
Incapsulamento in situ del fosfato ritardante di fiamma in una robusta matrice polimerica per batterie al litio metallico sicure e stabili quasi allo stato solido
Immagazzinamento di energia Materiali, 2021, 39: 186.
[12] ZHAO Q, LIU X, STALIN S, et al.
Polimero allo stato solido elettroliti con trasporto interfacciale veloce integrato per litio secondario batterie
Energia della natura, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J, et al.
Un robusto, altamente rivestimento estensibile che favorisce gli ioni per batterie stabili al litio metallico
Ingegneria chimica Giornale, 2020, 396: 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J, et al.
Fasi iniziali di decomposizione termica degli elettroliti delle batterie agli ioni di litio basate su LiPF6 mediante Raman e NMR dettagliati spettroscopia
RSC Advances, 2013, 3(37):16359.
[15] LIU F Q, WANG W P, YIN Y X et al.
Aggiornamento tradizionale elettrolita liquido tramite gelificazione in situ per il futuro litio batterie metalliche
Progressi scientifici, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, et al.
Livello interfaccia formazione in batterie al litio con elettrolita polimerico solido: uno studio XPS
Giornale dei materiali Chimica A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J, et al.
Ioni di litio superiori conduzione dell'elettrolita polimerico con struttura a pettine tramite assenza di solventi copolimerizzazione per batteria al litio bipolare interamente allo stato solido
Giornale dei materiali Chimica A, 2018, 6(27):13438.
[18] DI NOTO V, LAVINA S, GIFFIN G A, et al.
Elettroliti polimerici: presente, passato e futuro
Electrochimica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
Poli(etilene elettroliti a base di ossido) per batterie agli ioni di litio
Giornale dei materiali Chimica A, 2015, 3(38):19218.
[20] MINDEMARK J, LACEY M J, BOWDEN T, et al.
Al di là Materiali ospiti alternativi PEO per elettroliti polimerici solidi conduttori di Li+
Progresso nei polimeri Scienza, 2018, 81: 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S, et al.
Ioni di litio sali elettrolitici conduttori per batterie al litio
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
Elettroliti e interfasi nelle batterie agli ioni di litio e oltre
Recensioni chimiche, 2014, 114(23):11503.
[23] YANG H, ZHUANG G V, ROSS JR P N.
Stabilità termica di Batteria al sale e agli ioni di litio LiPF6 elettroliti contenenti LiPF6
Giornale del potere Fonti, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H, et al.
Bassa temperatura progettazione dell'elettrolita per batterie agli ioni di litio: prospettive e sfide
Chimica-Un europeo Diario, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R, et al.
Ciclo stabile di batterie al litio metallico ad alta tensione in elettroliti eterei
Energia della natura, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q, et al.
Operando previsto polimerizzazione all'anodo di litio tramite inserimento di boro
ACS Energy Letters, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K, et al.
Organico-inorganico SEI composito per un anodo metallico di litio stabile mediante polimerizzazione in situ
Nanoenergia, 2022, 95: 106983.
[28] CHENG S, SMITH D M, LI C Y.
Come funziona la nanoscala la struttura cristallina influenza il trasporto degli ioni negli elettroliti polimerici solidi?
Macromolecole, 2014, 47(12):3978.
[29] JOHANSSON P.
Primi principi modellazione di elettroliti polimerici amorfi: complessi Li+-PEO, Li+-PEI e Li+-PES
Polimero, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÜM K, et al.
A base di policarbonato elettroliti polimerici solidi per batterie agli ioni di litio
Solid State Ionics, 2014, 262: 738.
[31] SILVA M M, BARROS S C, SMITH M J et al.
Caratterizzazione di elettroliti polimerici solidi a base di poli (trimetilenecarbonato) e litio tetrafluoroborato
Electrochimica Acta, 2004, 49(12): 1887.
[32] BARBOSA P, RODRIGUES L, SILVA M M, et al.
Caratterizzazione di pTMCnLiPF6 elettroliti polimerici solidi
Ioni a stato solido, 2011, 193(1):39.