WANG Kunpeng,1, LIU Zhaolin2, LIN Cunsheng2, WANG Zhiyu,1,2
1. State Key Lab of Fine Chemicals, Scuola di Ingegneria Chimica, Università della Tecnologia di Dalian, Dalian 116024, Cina
2. Filiale di New Material Development, Valiant Co., Ltd., Yantai 265503, Cina
Astratto
Rispetto alle batterie agli ioni di litio, le batterie agli ioni di sodio offrono i vantaggi di basso costo, buone prestazioni a basse temperature e sicurezza, attirando grande attenzione nelle applicazioni sensibili ai costi e all'affidabilità. Con elevata capacità e basso costo, i materiali simili al blu di Prussia (PBA) rappresentano materiali catodici promettenti per le batterie agli ioni di Na. Tuttavia, la presenza di acqua cristallina all’interno della loro struttura induce un rapido decadimento delle prestazioni della batteria, fungendo da collo di bottiglia critico che ne limita l’applicazione. Questo lavoro riporta una semplice strategia di trattamento termico per rimuovere efficacemente l'acqua cristallina dai materiali catodici dei PBA, migliorando la ritenzione della capacità dal 73% all'88% dopo 340 cicli. L'analisi in situ rivela che la perdita iniziale di efficienza coulombiana del catodo PBA è il risultato della sua trasformazione irreversibile da una forma trigonale a una fase cubica durante il processo di carica e scarica. Questo problema può essere risolto introducendo Na2C2O4 per compensare la perdita irreversibile di Na nel catodo. Su questa base, viene costruita una batteria agli ioni di Na quasi allo stato solido ad alte prestazioni accoppiando un catodo PBA a basso contenuto di acqua con un additivo Na2C2O4 e un anodo di carbonio duro (HC) all'interno di un poli(etilenglicole) diacrilato (PEGDA ) a base di elettrolita quasi allo stato solido con elevata conduttività ionica e stabilità elettrochimica. Questa batteria presenta capacità specifiche che vanno da 58 a 105 mAh·g-1 con densità di corrente da 20 a 500 mA·g-1, in grado di sostenere un ciclo stabile per oltre 200 cicli. Questo studio sottolinea il significativo miglioramento della stabilità e della capacità dei materiali catodici dei PBA grazie all'efficace rimozione dell'acqua cristallina al loro interno.Parole chiaveï¼ Batteria agli ioni di Na; batteria quasi allo stato solido; Catodo blu di Prussia; analisi in situ
Lo sviluppo della tecnologia delle batterie ad alte prestazioni è una delle principali necessità strategiche per la Cina per trasformare e aggiornare la propria struttura energetica, promuovere un’economia pulita a basse emissioni di carbonio e raggiungere l’obiettivo della “neutralità del carbonio e del picco del carbonio”. Le batterie agli ioni di litio sono uno dei sistemi di batterie ad alta efficienza più utilizzati. Tuttavia, l’abbondanza di litio nella crosta terrestre è solo dello 0,0065%, le riserve di litio della Cina rappresentano solo il 7% del totale mondiale e quasi il 70% del carbonato di litio viene importato. In futuro sarà difficile soddisfare l’enorme domanda nel campo dello stoccaggio dell’energia e delle batterie di alimentazione. L'abbondanza di sodio nella crosta terrestre è oltre 400 volte superiore a quella del litio. Le riserve di sodio della Cina rappresentano circa il 22% delle riserve totali mondiali. Dal punto di vista dei costi delle materie prime, il costo delle batterie agli ioni di sodio può essere ridotto dal 30% al 40% rispetto alle batterie agli ioni di litio. Inoltre, rispetto alle batterie agli ioni di litio, le batterie agli ioni di sodio offrono migliori prestazioni a bassa temperatura, un intervallo di temperature operative più ampio e una maggiore sicurezza. Questi vantaggi unici li hanno resi al centro dell'attenzione nelle applicazioni di stoccaggio dell'energia sensibili ai costi e critiche per la sicurezza [1].
Spinta dall’obiettivo del “doppio carbonio”, la domanda cinese di batterie per lo stoccaggio dell’energia e l’alimentazione ha raggiunto i 158,5 GWh nel 2020, e si prevede che la domanda mondiale di batterie entrerà nell’era dei TWh nel 2025. Con il progresso della tecnologia delle batterie, la densità energetica delle batterie batterie è aumentato rapidamente e i requisiti per la sicurezza delle batterie sono diventati sempre più importanti. Le tradizionali batterie agli ioni di litio/sodio utilizzano elettroliti organici liquidi soggetti a perdite, il che riduce l'affidabilità della batteria [2-3]. L'uso di batterie allo stato solido con elevata stabilità termoelettrica, elevata resistenza meccanica e nessun rischio di perdite è una direzione fattibile per risolvere il problema dell'affidabilità [4-5], ma presenta problemi come l'elevata densità di elettroliti solidi, la bassa conduttività ionica e scarso contatto con l'interfaccia "solido-solido" degli elettrodi [6]. Gli elettroliti quasi solidi tra liquido e solido hanno una migliore stabilità e sicurezza rispetto agli elettroliti liquidi e sono superiori agli elettroliti solidi in termini di conduttività ionica, flessibilità e compatibilità di interfaccia [7–9]. Questi vantaggi rendono le batterie quasi allo stato solido basate su di essi una delle direzioni più fattibili nel campo della tecnologia avanzata delle batterie.
I composti del blu di Prussia (PBA) sono attualmente i materiali catodici più popolari per le batterie agli ioni di sodio. La loro struttura a scheletro aperto e gli abbondanti siti di stoccaggio del sodio conferiscono loro un'elevata capacità specifica teorica (170 mAh g-1) e buone prestazioni di trasporto ionico [10-11]. Nelle batterie allo stato solido, i PBA possono essere utilizzati non solo come materiali catodici ma anche come elettroliti solidi [12-13]. Tuttavia, i PBA sono generalmente preparati mediante precipitazione della soluzione, che formerà difetti di posti vacanti di Fe(CN)64 e una grande quantità di acqua cristallina nella loro struttura, ostacolando l'incorporamento di Na+ nel reticolo dei PBA e limitando la loro capacità di stoccaggio del sodio. Inoltre, l’acqua cristallina contenuta nei PBA verrà gradualmente rilasciata nell’elettrolita durante la reazione della batteria, portando a un rapido decadimento delle prestazioni della batteria, reazioni collaterali, flatulenza e altri problemi [11,14]. Questi problemi limitano l’applicazione dei PBA nelle batterie a stato solido e rendono difficile abbinarli alla maggior parte degli elettroliti solidi inorganici sensibili all’acqua. La formazione di difetti di posti vacanti e di acqua cristallina nei PBA può essere efficacemente inibita da strategie come il trattamento idrotermale[15], la coprecipitazione lenta[16], l'inibizione dell'ossidazione Fe2+[17], l'attacco chimico[18] e il drogaggio degli elementi[19- 20]. Tuttavia, i processi tecnici rilevanti sono complessi e difficili da controllare con precisione, e anche le prestazioni dei catodi PBA ottenuti devono essere migliorate. Alla luce dei problemi di cui sopra, questo studio propone un metodo di trattamento termico semplice ed efficiente per ridurre il contenuto di acqua cristallina nei PBA e migliorare la loro stabilità di stoccaggio del sodio. Attraverso la tecnologia di polimerizzazione in situ, è stato sviluppato un elettrolita solido di riferimento con polietilenglicole diacrilato (PEGDA) con elevata conduttività ionica ed elevata stabilità elettrochimica. Su questa base, il catodo PBA a basso contenuto di acqua e l'anodo di carbonio duro (HC) sono stati abbinati nell'elettrolita solido di riferimento PEGDA e Na2C2O4 è stato aggiunto al catodo come compensatore auto-sacrificale di sodio per costruire un quasi- batteria agli ioni di sodio allo stato solido. Il meccanismo dinamico di stoccaggio del sodio del catodo PBA e dell'anodo HC è stato rivelato dalla tecnologia di analisi in situ.
1 Metodo sperimentale
1.1 Preparazione del catodo PBA a basso contenuto di acqua
116 mmol di citrato di sodio e 24 mmol di FeSO4·7H2O sono stati sciolti in 400 mL di acqua deionizzata deossigenata. 116 mmol di citrato di sodio e 26 mmol di Na4Fe(CN)6 sono stati sciolti in 400 mL di acqua deionizzata deossigenata. La soluzione contenente FeSO4 è stata aggiunta lentamente alla soluzione contenente Na4Fe(CN)6 e la reazione è stata agitata a temperatura costante per 6 ore. Il prodotto è stato lavato tre volte mediante centrifugazione con etanolo e acqua deionizzata deossigenata ed essiccato sotto vuoto a 120 °C per 24 ore per ottenere PBA con elevato contenuto di acqua cristallina (Hw-PBA). È stato posto in un forno tubolare protetto da argon e calcinato a 270 ℃ per 2 ore per ottenere PBA a basso contenuto di acqua (Lw-PBA), con una velocità di riscaldamento di 0,5 ℃·min-1.
1.2 Caratterizzazione del campione
La morfologia e la struttura del campione sono state analizzate utilizzando un microscopio elettronico a scansione a emissione di campo. La composizione chimica del campione è stata analizzata utilizzando uno spettrometro fotoelettronico a raggi X e uno spettrometro a emissione di plasma accoppiato induttivamente. La batteria è stata analizzata in situ utilizzando un diffrattometro a raggi X per polveri e una spettroscopia Raman laser. Il contenuto di acqua cristallina del campione è stato analizzato utilizzando un analizzatore termogravimetrico in un'atmosfera di argon a una velocità di riscaldamento di 10 â·min-1.
1.3 Assemblaggio della batteria e test delle prestazioni elettrochimiche
1.3.1 Gruppo semibatteria agli ioni di sodio liquido
Per i test sono state assemblate pile a bottone CR2016. Il materiale catodico del blu di Prussia (Hw-PBA o Lw-PBA), il nero Ketjen (KB) e il legante polivinilidene fluoruro (PVDF) sono stati miscelati uniformemente in un rapporto di massa di 8:1:1, N-metilpirrolidone (NMP) è stato aggiunto come solvente e disperdente, e l'impasto liquido risultante è stato uniformemente rivestito su un foglio di alluminio rivestito di carbonio come catodo, con un carico di materiale attivo di 3~4 mg·cm-2. Come controelettrodi ed elettrodi di riferimento sono stati utilizzati fogli metallici di sodio. L'elettrolita era una soluzione DMC/EC (DMC: dimetil carbonato, EC: etilene carbonato, rapporto volumetrico 1:1) di 1,0 mol·L-1 NaClO4 e 5,0% di fluoroetilene carbonato (FEC). La batteria è stata assemblata in un vano portaoggetti riempito di argon (contenuto di acqua <10-7, contenuto di ossigeno <10-7).
1.3.2 Gruppo batteria completa agli ioni di sodio liquido
L'elettrodo positivo è stato preparato utilizzando il metodo sopra descritto, HC è stato utilizzato come elettrodo negativo e il rapporto N/P degli elettrodi positivo e negativo è stato controllato a 1,1~1,2. La batteria è stata assemblata in un vano portaoggetti riempito con argon (contenuto di acqua <10-7, contenuto di ossigeno <10-7) utilizzando l'elettrolita sopra indicato.
1.3.3 Preparazione dell'elettrolita quasi solido
PEGDA è stato miscelato con l'elettrolita liquido di cui sopra con un rapporto in massa di 7:93. Il 5,0% di azobisisobutirronitrile (AIBN) è stato aggiunto come iniziatore della polimerizzazione per formare una soluzione precursore di elettrolita quasi solido. Questa soluzione è stata riscaldata a 60 °C per 10 ore per formare un elettrolita quasi solido.
1.3.4 Assemblaggio di una batteria completa agli ioni di sodio quasi allo stato solido
Il materiale dell'elettrodo positivo, il supplemento di sodio Na2C2O4, l'agente conduttivo KB e il legante PVDF sono stati miscelati uniformemente in un rapporto di massa di 6,4: 1,6: 1,0: 1,0, è stato aggiunto NMP come solvente e disperdente e l'impasto liquido ottenuto è stato rivestito uniformemente su un carbone foglio di alluminio rivestito come elettrodo positivo, con un carico di materiale attivo di 3~4 mg·cm-2. HC è stato utilizzato come elettrodo negativo e il rapporto N/P degli elettrodi positivi e negativi è stato controllato a 1,1~1,2. La soluzione precursore dell'elettrolita quasi solido è stata aggiunta alla batteria e, dopo che la batteria è stata incapsulata, è stata riscaldata a 60 °C per 10 ore per ottenere una batteria quasi allo stato solido. La batteria è stata assemblata in un vano portaoggetti riempito con argon (contenuto di acqua <10-7, contenuto di ossigeno <10-7).
1.3.5 Test delle prestazioni della batteria
La conduttività ionica dell'elettrolita quasi solido è stata testata mediante spettroscopia di impedenza elettrochimica (EIS) utilizzando una stazione di lavoro elettrochimica. L'intervallo di frequenza del test era 1 Hz~1000 kHz e l'ampiezza della tensione di perturbazione era 5,0 mV. La finestra di stabilità elettrochimica dell'elettrolita quasi solido è stata testata mediante voltammetria a scansione lineare (LSV) con una velocità di scansione di 5 mV·s-1. Il materiale e le prestazioni della batteria sono stati studiati mediante il metodo di carica e scarica a corrente costante utilizzando un tester per batterie Land CT2001A. La finestra di tensione della mezza cella era di 2,0~3,8 V (rispetto a Na/Na+), la finestra di tensione della cella intera era di 1,5~3,8 V e la densità di corrente era di 10~500 mA·g-1. Durante il test della stabilità del ciclo, la batteria è stata prima sottoposta a cicli di 5 volte con una densità di corrente di 50 mA·g-1, quindi il test di stabilità del ciclo è stato eseguito a diverse densità di corrente.
2 Risultati e discussione
2.1 Analisi morfologica e compositiva
La curva TGA degli Hw-PBA nella Figura 1 (a) mostra due regioni di rapida perdita di peso: 1) temperatura ambiente fino a 270 °C, 2) da 440 a 580 °C. Nella prima regione, la perdita di peso dalla temperatura ambiente a 120 °C (frazione di massa 3,1%) è causata dalla rimozione dell'acqua adsorbita; la perdita di peso da 120 a 200 °C (frazione di massa 6,10%) è causata dalla rimozione dell'acqua interstiziale nella struttura strutturale dei PBA; la perdita di peso da 200 a 270 °C (frazione di massa 6,89%) corrisponde alla rimozione dell'acqua cristallina nei PBA. Pertanto, è stato selezionato un trattamento termico a 270 ° C per rimuovere l'acqua dagli Hw-PBA. Dopo il trattamento termico a questa temperatura, gli Lw-PBA ottenuti hanno perso solo circa l'1,18% del loro peso a temperatura ambiente ~270 ℃, che era inferiore del 92,67% a quello degli Hw-PBA; e hanno perso circa lo 0,74% del loro peso a 200~270 ℃, che era inferiore dell'89,26% a quello degli Hw-PBA. I risultati di cui sopra mostrano che il trattamento termico può rimuovere efficacemente diversi tipi di acqua nei PBA e che i PBA a basso contenuto di acqua ottenuti hanno una buona stabilità termica.
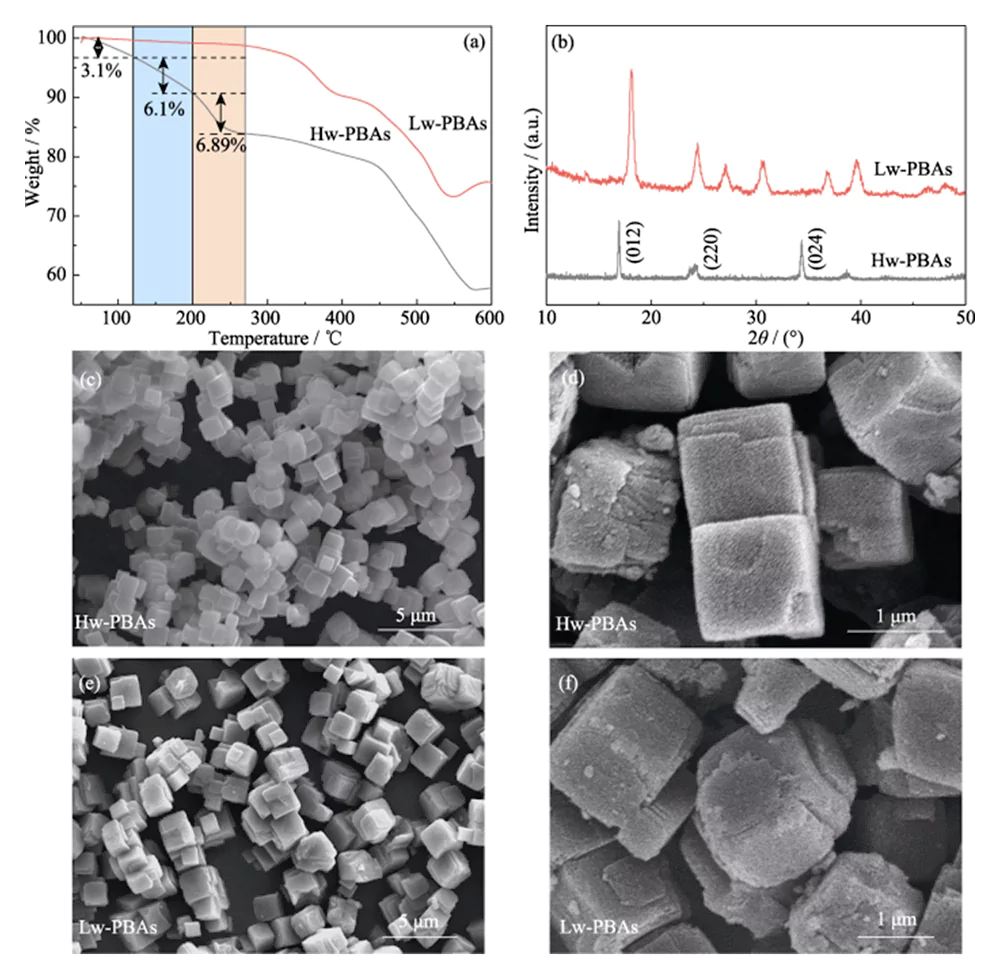
Fig. 1 TGA, analisi morfologiche e strutturali del catodo dei PBA
(a) curve TGA e (b) modelli XRD di Hw-PBA e Lw-PBA; (c-f) Immagini SEM di (c, d) Hw-PBA e (e, f) Lw-PBA
La Figura 1 (b) mostra gli spettri XRD di Hw-PBA e Lw-PBA. I picchi di diffrazione di Hw-PBA a 2θ=17,0°, 24,0° e 34,4° corrispondono rispettivamente ai piani cristallini (012), (220) e (024). Dopo il trattamento termico, il picco di diffrazione corrispondente al piano cristallino (024) scompare, indicando che l'acqua cristallina è stata rimossa con successo, e le posizioni dei picchi di diffrazione corrispondenti ai piani cristallini (012) e (220) si spostano ad angoli più alti, indicando che il volume della cella unitaria diminuisce dopo la rimozione dell'acqua cristallina. Inoltre, nuovi picchi di diffrazione compaiono a 2θ=27,1°, 30,7° e 36,9°, indicando che dopo il trattamento termico si forma una struttura cristallina trigonale. L'analisi SEM (Figura 1(c~e)) mostra che Hw-PBA e Lw-PBA hanno morfologie cubiche simili con una dimensione media di 2~3 µm. La superficie delle particelle Lw-PBA ottenute dopo il trattamento termico è leggermente ruvida (Figura 1(f)), ma a causa della bassa temperatura del trattamento termico non si sono verificate fusioni e agglomerazioni evidenti. La composizione di Lw-PBA è stata stimata essere Na1,91Fe- [Fe(CN)6]·3,2H2O analizzando il contenuto di elementi metallici mediante ICP-OES e misurando il contenuto di acqua mediante TGA.Per esplorare ulteriormente la composizione chimica e la struttura degli Hw-PBA e Lw-PBA, è stata eseguita l'analisi XPS. Nello spettro Fe2p XPS ad alta risoluzione degli Hw-PBA, i due picchi caratteristici alle energie di legame di 708,6 e 721,4 eV corrispondono rispettivamente a Fe (II) e Fe (III) (Figura 2 (a)). Fe(II) e Fe(III) esistono anche negli Lw-PBA, ma la proporzione di Fe(III) aumenta in modo significativo (Figura 2(b)). Questo perché [NaH2O]+ viene rimosso dalla struttura dei PBA durante il processo di trattamento termico e il Fe(II) negli Lw-PBA viene parzialmente ossidato per mantenere l'equilibrio di valenza. Nello spettro XPS O1s ad alta risoluzione degli Hw-PBA, i picchi caratteristici alle energie di legame di 536,0, 533,7, 531,9 e 529,7 eV corrispondono rispettivamente all'acqua interstiziale, all'acqua coordinata, ai gruppi idrossilici superficiali e alle specie di ossigeno nel reticolo dei PBA (Figura 2(c)). Dopo il trattamento termico, il picco caratteristico corrispondente all'acqua coordinata scompare, indicando che questo processo può rimuovere efficacemente l'acqua coordinata dagli Lw-PBA (Figura 2 (d)). Durante questo processo, il Fe sulla superficie dei PBA reagisce con i gruppi ossidrile per formare ossidi di ferro, provocando un notevole aumento del picco caratteristico Fe-O all'energia di legame di 530,0 eV.
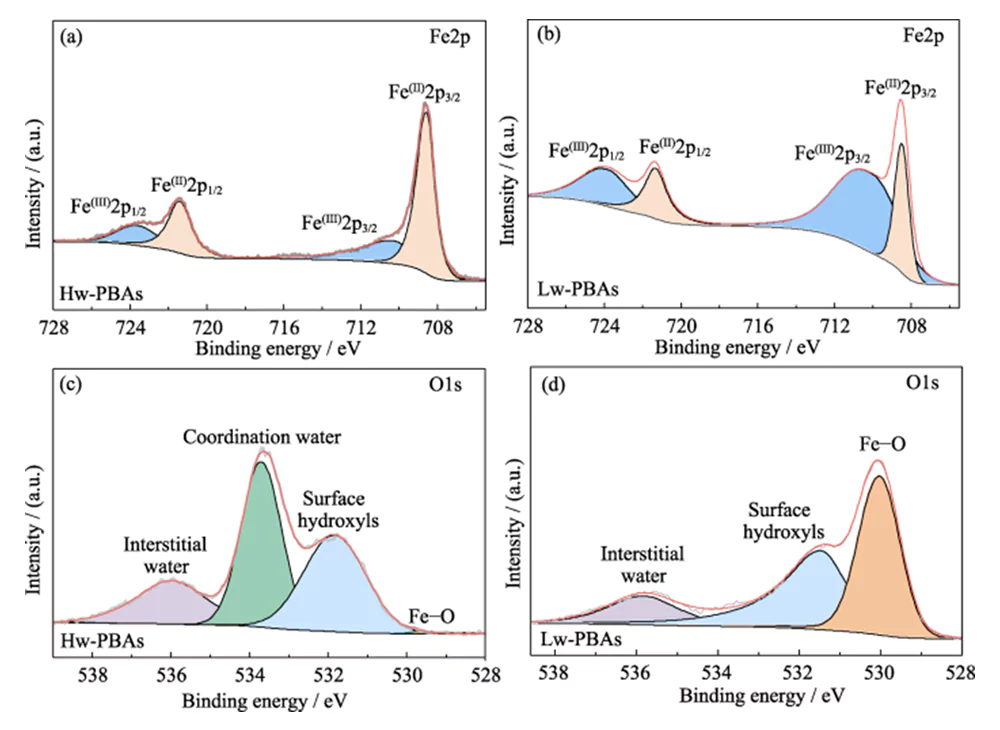
Fig. 2 Composizione chimica del catodo dei PBA
(a, b) spettri Fe2p XPS di (a) Hw-PBA e (b) Lw-PBA; (c, d) Spettri XPS O1s di (c) Hw-PBA e (d) Lw-PBA
2.2 Prestazioni elettrochimiche
La Figura 3(a) mostra le curve del ciclo carica-scarica a corrente costante delle semicelle di ioni sodio con Hw-PBA e Lw-PBA come elettrodi positivi a una densità di corrente di 100 mA·g-1, con una finestra di tensione di 2,0~ 3,8 V (rispetto a Na/Na+). Dopo 340 cicli di carica-scarica, l'elettrodo positivo Lw-PBAs può ancora mantenere un'elevata capacità specifica di 91 mAh·g-1, con un tasso di ritenzione della capacità dell'88% e un tasso medio di perdita di capacità di carica-scarica singola di soli 0,035 %, mostrando un'eccellente stabilità del ciclo. Nelle stesse condizioni di carica-scarica, il tasso di ritenzione della capacità dell'elettrodo positivo Hw-PBA senza la rimozione dell'acqua cristallina è solo del 73%, dimostrando l'importante ruolo della rimozione dell'acqua cristallina nel migliorare la stabilità del ciclo dell'elettrodo positivo PBA. La Figura 3(b) mostra la curva carica-scarica a corrente costante del catodo Lw-PBA con una densità di corrente di 100 mA·g-1, mostrando una caratteristica tipica della piattaforma a doppia tensione: (1) La piattaforma di tensione di circa 3,2 V corrisponde al processo redox di Fe2+/Fe3+ a basso spin (coordinato con C); (2) La piattaforma di tensione di circa 2,9 V corrisponde al processo redox di Fe2+/Fe3+ ad alto spin (coordinato con N). La comparsa di una piattaforma di tensione a circa 3,2 V indica che la rimozione dell'acqua cristallina è vantaggiosa per rafforzare la reazione redox di Fe2+/Fe3+ a basso spin nei PBA, il che aiuta a migliorare la capacità di stoccaggio del sodio. Nel processo del ciclo successivo, la curva carica-scarica del catodo Lw-PBA è rimasta sostanzialmente costante, mostrando una buona stabilità strutturale. Alle densità di corrente di 10, 50, 100, 200 e 500 mA·g-1, il catodo Lw-PBAs può mantenere elevate capacità specifiche reversibili di 126, 112, 110, 108 e 107 mAh·g-1 (Figura 3 (C)). In particolare, con un'elevata densità di corrente di 500 mA·g-1, il catodo Lw-PBAs ha un'eccellente ritenzione di capacità e la sua capacità specifica è circa il 13,4% superiore a quella degli Hw-PBAs. Quando la densità di corrente ritorna a 10 mA·g-1, la capacità specifica del catodo Lw-PBAs può essere ripristinata a 125 mAh·g-1, che è vicina alla capacità specifica iniziale, indicando che può mantenere un'eccellente capacità strutturale stabilità durante lo stoccaggio rapido del sodio.
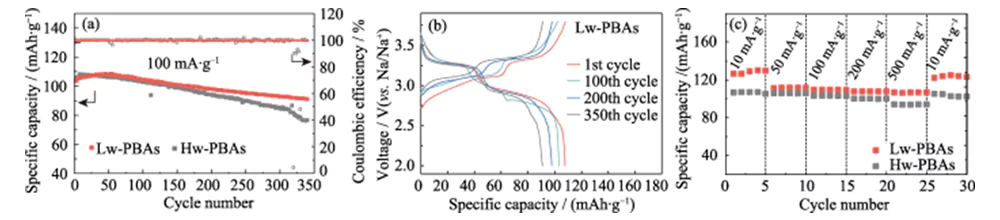
Fig. 3 Prestazioni elettrochimiche del catodo PBA in semicella di ioni Na
(a) Prestazioni cicliche dei catodi Lw-PBA e Hw-PBA a una densità di corrente di 100 mA·g-1; (b) Curve di carica-scarica del catodo Lw-PBA a 100 mA·g-1; (c) Capacità di velocità dei catodi Lw-PBA e Hw-PBA a varie densità di corrente da 10 mA·g-1 a 500 mA·g-1; La finestra di tensione è 2,0-3,8 V (rispetto a Na/Na+) per tutti i test su semicella; Le figure colorate sono disponibili sul sito web
2.3 Analisi in situ del meccanismo di stoccaggio del sodio
L'elettrodo positivo Lw-PBAs è stato abbinato all'elettrodo negativo HC e una soluzione DMC/EC contenente 1,0 mol·L-1 NaClO4 e 5,0% FEC in massa è stata utilizzata come elettrolita liquido (LE) per assemblare una batteria completa (Lw -PBA|LE|HC, Figura 4(a)). I cambiamenti strutturali dinamici dei materiali degli elettrodi positivi e negativi dell'intera batteria durante le reazioni di carica e scarica sono stati studiati utilizzando la tecnologia di analisi in situ. L'analisi XRD in situ dell'elettrodo positivo Lw-PBA ha mostrato che dopo che la tensione di carica è stata aumentata a 3,2 V, i picchi di diffrazione corrispondenti a (110) e (104) si sono gradualmente fusi per formare un ampio picco (Figura 4 (b) ). Questo fenomeno corrisponde al processo di fuga di Na+ dall'elettrodo positivo Lw-PBAs, facendo sì che la sua struttura cristallina cambi da una struttura trigonale a una struttura cubica[21]. Durante il processo di scarica, non è stata osservata alcuna nuova suddivisione di questo ampio picco nei picchi di diffrazione (110) e (104), indicando che il processo di cambiamento di fase è irreversibile, con conseguente prima perdita di efficienza coulombiana. Inoltre, durante il primo processo di carica e scarica dell'elettrodo negativo HC, il film interfase elettrolitico solido (SEI) formato sulla superficie porta ad una perdita irreversibile di litio (18%), che è anche uno dei motivi della prima efficienza coulombiana perdita dell'intera batteria (Figura 4 (c, d)).
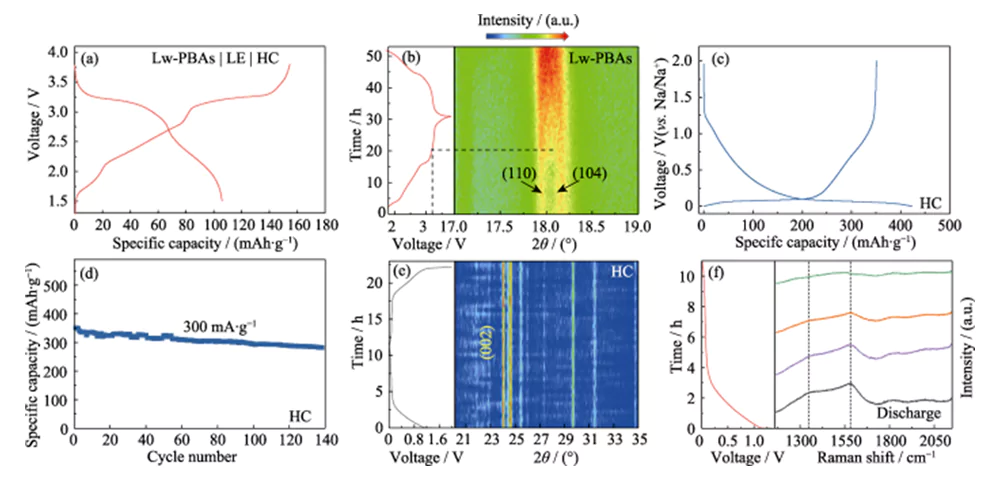
Fig. 4 Analisi in situ del meccanismo di stoccaggio del Na per il catodo Lw-PBA e l'anodo HC
(a) Curve carica-scarica di Lw-PBA|LE|HC a cella intera; (b) Modello XRD in situ del catodo Lw-PBA durante il funzionamento della cella completa; (c) Curve carica-scarica per il primo ciclo e (d) stabilità ciclica dell'anodo HC a una densità di corrente di 300 mA·g-1; (e) modello XRD in situ e (f) spettri Raman in situ dell'anodo HC durante il funzionamento della cella completa; Le figure colorate sono disponibili sul sito web
Nello spettro XRD in situ dell'anodo HC, non è stato osservato alcun evidente spostamento del picco (002) durante il processo di carica e scarica, indicando che Na+ non era inserito negli strati della struttura grafitizzata, e non sono stati osservati picchi di diffrazione dal sodio metallico ( Figura 4(e)). Pertanto, la capacità di stoccaggio del sodio dell’anodo HC può essere dovuta all’adsorbimento e al riempimento di Na+ nei siti ricchi di difetti e nei pori dell’HC, piuttosto che all’intercalazione di Na+ o alla precipitazione di sodio metallico [22]. Per studiare ulteriormente il meccanismo di reazione di accumulo del sodio nell'HC, è stata eseguita l'analisi Raman in situ sull'elettrodo negativo dell'HC durante il processo di carica e scarica (Figura 4(f)). L'elettrodo negativo HC presenta evidenti picchi caratteristici Raman a 1350 e 1594 cm-1. Il picco caratteristico con un numero d'onda di 1350 cm-1 corrisponde alla vibrazione di stiramento della configurazione del carbonio aromatico (modalità G), e il picco caratteristico con un numero d'onda di 1594 cm-1 corrisponde alla struttura di carbonio difettosa disordinata (modalità D). Il rapporto di intensità della modalità D e della modalità G (ID/IG) può essere utilizzato per misurare il grado di difetti e il disordine dei materiali in carbonio. Durante il processo di scarica, l'ID/IG dell'anodo HC è diminuito con la continua intercalazione di Na+, indicando che il significativo comportamento di adsorbimento di Na+ nei suoi siti difettosi è la principale fonte della capacità di stoccaggio del sodio dell'anodo HC.
2.4 Costruzione e prestazioni di celle intere quasi allo stato solido
La prima efficienza coulombiana della cella intera agli ioni di sodio costruita utilizzando l'elettrodo positivo Lw-PBA e l'elettrodo negativo HC è solo del 67,3% (Figura 4 (a)). Per affrontare questo problema, Na2C2O4 rispettoso dell’ambiente, poco tossico e stabile all’aria viene utilizzato come compensatore auto-sacrificale del sodio nell’elettrodo positivo Lw-PBA per migliorare la prima efficienza coulombica della cella intera [23]. La dimensione delle particelle di Na2C2O4 commerciale è superiore a centinaia di micron e ha una scarsa attività elettrochimica. Pertanto, viene ricristallizzato per ottenere Na2C2O4 con una dimensione delle particelle di diversi micron (Figura 5 (a)). Na2C2O4 delle dimensioni di un micron può rilasciare un'elevata capacità specifica di 407 mAh·gâ1 durante il primo processo di carica all'interno della finestra di tensione di 2,0~4,2 V, compensando efficacemente la prima perdita irreversibile di capacità dell'elettrodo positivo (Figura 5(b )). La capacità specifica di scarica iniziale della cella piena Lw-PBAs|LE|HC con l'aggiunta di Na2C2O4 (frazione di massa 20%) può raggiungere 158 mAh·g-1, che è superiore del 92,7% a quella della cella piena senza l'aggiunta di Na2C2O4 (Figura 5(c)). La cella intera Lw-PBAs|LE|HC con l'aggiunta di Na2C2O4 può mantenere una capacità specifica reversibile di 110, 101, 92, 87 e 80 mAh·g-1 a densità di corrente di 10, 50, 100, 200 e 500 mA ·g-1 (Figura 5(d)). Con un'elevata densità di corrente di 500 mA·g-1, dopo 1400 cicli stabili, la cella completa Lw-PBAs|LE|HC con l'aggiunta di Na2C2O4 può mantenere una capacità specifica di 64 mAh·g-1, ovvero del 25,4% superiore a quello della cella intera senza l'aggiunta di Na2C2O4 (Figura 5(e)).
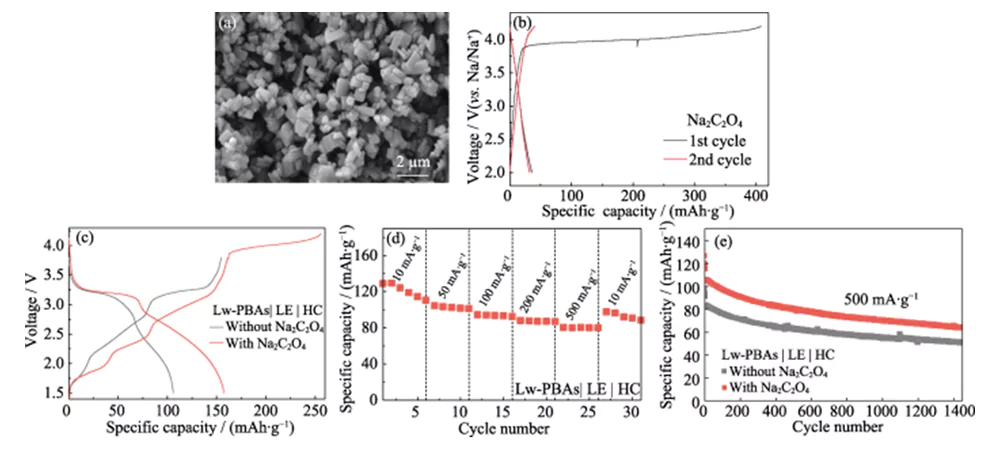
Fig. 5 Effetto di Na2C2O4 sulle prestazioni elettrochimiche del catodo Lw-PBAs
(a) immagine SEM e (b) curve di carica-scarica di Na2C2O4 con dimensioni micrometriche ad una densità di corrente di 180 mA·g-1; (c) Curve carica-scarica di celle complete Lw-PBAs|LE|HC con o senza l'adozione di Na2C2O4 a una densità di corrente di 100 mA·g-1; (d) Valutare le prestazioni della cella intera Lw-PBA|LE|HC con Na2C2O4 a varie densità di corrente da 10 a 500 mA·g-1; (e) Stabilità ciclistica della cella intera Lw-PBAs|LE|HC con o senza l'uso di Na2C2O4 a un'elevata densità di corrente di 500 mA·g-1; La finestra di tensione è 1,5-3,8 V per tutti i test a cella intera; Le figure colorate sono disponibili sul sito web
Su questa base, PEGDA è stato miscelato con 1,0 mol·L-1 NaClO4 e elettrolita DMC/EC con una frazione di massa del 5,0% FEC, e AIBN è stato utilizzato come iniziatore della polimerizzazione termica per sviluppare un elettrolita quasi solido ad alte prestazioni (GPE ). Rispetto a LE, GPE presenta il vantaggio di essere meno soggetto a perdite e di bassa volatilità. Può rimanere stabile a una tensione elevata di 4,9 V (rispetto a Na/Na+) e presenta un'ampia finestra di stabilità elettrochimica (Figura 6(a)). Rispetto agli elettroliti solidi, il GPE presenta una maggiore conduttività ionica e compatibilità di interfaccia, mentre la conduttività ionica a temperatura ambiente è 3,51 mS·cm-1 (Figura 6(b)). È stato ulteriormente abbinato all'elettrodo positivo Lw-PBAs a basso contenuto di acqua e all'elettrodo negativo HC per costruire una batteria completa agli ioni di sodio quasi allo stato solido (Lw-PBAs|GPE|HC). Con una densità di corrente di 100 mA·g-1, la capacità specifica della prima scarica della batteria quasi allo stato solido Lw-PBAs|GPE|HC ha raggiunto 147,8 mAh·g-1 (Figura 6(c)). Alle densità attuali di 20, 50, 100, 200 e 500 mA·g-1, le capacità specifiche possono essere mantenute a 105, 94, 82, 70 e 58 mAh·g-1 (Figura 6(d)). Con una densità di corrente di 100 mA·g-1, può essere sottoposto a cicli stabili per più di 200 volte e l'efficienza Coulombiana è vicina al 100% (Figura 6(e)).
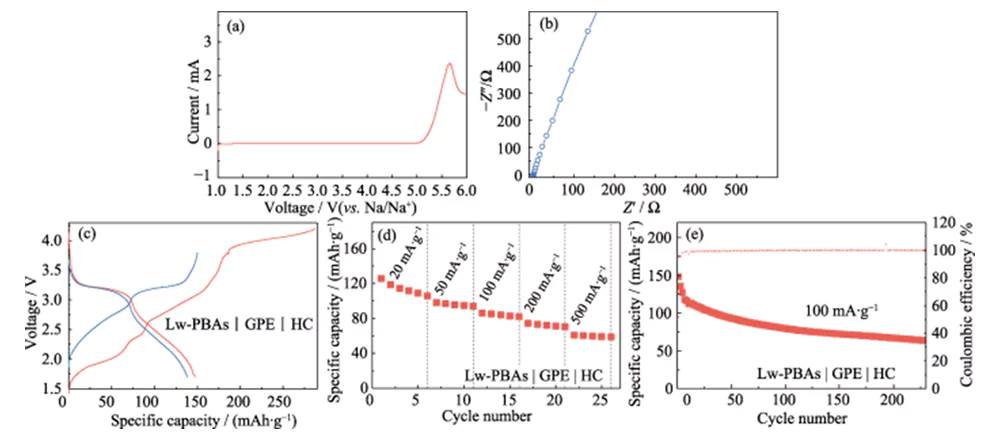
Fig. 6 Prestazioni elettrochimiche di celle complete allo stato quasi solido basate su catodo Lw-PBA e GPE basato su PEGDA
(a) Curva LSV a una velocità di scansione di 5 mV·s-1; (b) spettro EIS; (c) Curve di carica-scarica a una densità di corrente di 100 mA·g-1; (d) Prestazioni valutarie a densità di corrente di 20-500 mA·g-1; (e) Prestazioni ciclistiche a 100 mA·g-1; La finestra di tensione è 1,5-3,8 V per tutti i test a cella intera
3 Conclusione
In questo studio, i materiali catodici PBA a basso contenuto di acqua sono stati preparati mediante un metodo di trattamento termico semplice ed efficiente. Si è scoperto che la rimozione dell'acqua cristallina non solo ha aumentato il tasso di ritenzione della capacità del catodo dei PBA dal 73% all'88% dopo 340 cicli, ma ha anche contribuito a rafforzare la reazione redox di Fe2+/Fe3+ a basso spin nei PBA, migliorando così la sua capacità di immagazzinamento del sodio. Il meccanismo dinamico di stoccaggio del sodio del catodo PBA e dell'anodo HC è stato rivelato mediante tecniche Raman in situ e XRD in situ. L'analisi ha mostrato che il processo di fuga di Na+ dal catodo del PBA ha causato un cambiamento irreversibile della sua struttura cristallina da cubica tridimensionale, con conseguente perdita del primol’efficienza coulombiana e l’adsorbimento di Na+ nei suoi siti difettosi erano la principale fonte della capacità di stoccaggio del sodio dell’anodo HC. Dopo aver aggiunto il compensatore di sodio Na2C2O4 (frazione di massa 20%) al catodo, la prima capacità di scarica del catodo PBA è aumentata del 92,7%. Sulla base della polimerizzazione termica del PEGDA avviata da AIBN, è stato sviluppato un elettrolita quasi solido ad alte prestazioni con conduttività ionica a temperatura ambiente di 3,51 mS·cm-1 e finestra di stabilità elettrochimica ampliata a 4,9 V (rispetto a Na/Na+). Su questa base, un catodo PBA a basso contenuto di acqua con l'aggiunta di un compensatore di sodio Na2C2O4, un anodo HC e un elettrolita solido di riferimento PEGDA sono stati integrati per costruire una batteria agli ioni di sodio quasi allo stato solido che può essere ciclata stabilmente per più di 200 volte a una densità di corrente di 100 mA·g-1. Gli studi hanno dimostrato che la rimozione efficiente dell'acqua cristallina è un mezzo necessario per migliorare la stabilità del ciclo del catodo dei PBA e realizzare la creazione di batterie agli ioni di sodio quasi allo stato solido ad alte prestazioni.
[1] WANG W L, GANG Y, PENG J, et al. Effetto dell'eliminazione dell'acqua nel catodo blu di Prussia per batterie agli ioni di sodio. Avv. Funz. Mater., 2022, 32(25): 2111727.
[2] MENG X Y, LIU Y Z, WANG Z Y, et al. Una cella ricaricabile quasi allo stato solido con elevata energia e sicurezza superiore resa possibile dalla chimica redox stabile del Li2S nell'elettrolita gel. Ambiente energetico. Sci., 2021, 14(4): 2278.
[3] CHE H Y, CHEN S L, XIE Y Y, et al. Strategie di progettazione degli elettroliti e progressi della ricerca per batterie agli ioni di sodio a temperatura ambiente. Ambiente energetico. Sci., 2017, 10(5): 1075.
[4] LI W K, ZHAO N, BI Z J, et al. Elettroliti ceramici Na3Zr2Si2PO12 per batterie agli ioni di Na: preparazione mediante il metodo di essiccazione a spruzzo e sue proprietà. J.Inorg. Mater., 2022, 37(2): 189.
[5] LI D, LEI C, LAI H, et al. Recenti progressi nell'interfaccia tra catodo ed elettrolita solido granato per tutte le batterie agli ioni di litio a stato solido. J.Inorg. Mater., 2019, 34(7): 694.
[6] KIM KJ, BALAISH M, WADAGUCHI M, et al. Batterie al litio-metallo allo stato solido: sfide e orizzonti degli elettroliti solidi di ossido e solfuro e delle loro interfacce. Avv. Energia Mater., 2021, 11(1): 2002689.
[7] GAO H, GUO B, SONG J, et al. Un elettrolita composito gel-polimero/fibra di vetro per batterie agli ioni di sodio. Avv. Energia Mater., 2015, 5(9): 1402235.
[8] LIU Y Z, MENG X Y, SHI Y, et al. Batterie prive di anodi quasi allo stato solido di lunga durata abilitate dall'ingegneria dell'interfaccia accoppiata con compensazione del litio. Avv. Mater., 2023, 35(42): e2305386.
[9] DU G Y, TAO M L, LI J, et al. Batteria agli ioni di sodio allo stato solido, a bassa temperatura di esercizio, ad alta velocità e di lunga durata, basata su elettrolita polimerico e catodo blu di Prussia. Avv. Energia Mater., 2020, 10(5): 1903351.
[10] PENG J, ZHANG W, LIU Q N, et al. Analoghi del blu di Prussia per batterie agli ioni di sodio: passato, presente e futuro. Avv. Mater., 2022, 34(15): 2108384.
[11] LU Y H, WANG L, CHENG J G, et al. Blu di Prussia: un nuovo quadro di materiali per elettrodi per batterie al sodio. Chimica. Comunione, 2012, 48(52): 6544.
[12] Süngeland C, MOGENSEN R, BRANDELL D, et al. Cicli stabili delle batterie allo stato solido al sodio metallico con elettroliti polimerici a base di policarbonato. Richiesta ACS. Poli. Mater., 2019, 1(4): 825.
[13] KIM T, AHN S H, SONG Y Y, et al. Elettroliti solidi conduttori di ioni di sodio tipo blu di Prussia per tutte le batterie a stato solido. Angew. Chimica. interno Ed., 2023, 62(42): e202309852.
[14] SONG J, WANG L, LU Y H, et al. Rimozione di H2O interstiziale negli esacianometallati per un catodo superiore di una batteria agli ioni di sodio. J. Am. Chimica. Soc., 2015, 137(7): 2658.
[15] LIU Y, FAN S, GAO Y, et al. Sintesi isostrutturale di analoghi del blu di Prussia a base di ferro per batterie agli ioni di sodio. Piccolo, 2023, 19(43): e2302687.
[16] WANG W, GANG Y, HU Z, et al. Evoluzione strutturale reversibile del blu di Prussia romboedrico ricco di sodio per batterie agli ioni di sodio. Naz. Comunione, 2020, 11: 980.
[17] TU Y, YU X Q, YIN Y X, et al. Esacianoferrato di sodio e ferro con elevato contenuto di Na come materiale catodico ricco di Na per batterie agli ioni di Na. Nano Res., 2014, 8(1): 117.
[18] REN WH, QIN MS, ZHU Z X, et al. Attivazione dei siti di stoccaggio del sodio negli analoghi del blu di Prussia tramite attacco superficiale. Nano Lett., 2017, 17(8): 4713.
[19] ZHANG H, GAO Y, PENG J, et al. Analoghi del blu di Prussia con orientamento del piano cristallino ottimizzato e bassi difetti del cristallo rispetto alle batterie agli ioni alcalini da 450 Wh·kgâ1. Angew. Chimica. interno Ed., 2023, 62(27): e202303953.
[20] ZHANG Z H, AVDEEV M, CHEN H C, et al. Analoghi del blu di Prussia litiati come materiali attivi per elettrodi positivi per batterie stabili agli ioni di litio non acquose. Naz. Comun., 2022, 13: 7790.
[21] JIANG M, HOU Z, MA H, et al. Risoluzione della disattivazione dei siti Fe a basso spin ridistribuendo la densità elettronica verso l'accumulo di sodio ad alta energia. Nano Lett., 2023, 23(22): 10423.
[22] TANG Z, ZHANG R, WANG H Y, et al. Rivelazione della formazione di pori chiusi di carbonio duro derivato dal legno di scarto per batterie avanzate agli ioni di sodio. Naz. Comunione, 2023, 14: 6024.
[23] NIU Y B, GUO Y J, YIN Y X, et al. Compensazione del sodio catodico ad alta efficienza per batterie agli ioni di sodio. Avv. Mater., 2020, 32(33): e2001419.





